ZusammensetzungWirkstoffe
Calcitoninum salmonis.
Hilfsstoffe
Benzalkonii chloridum (0.009 mg pro Sprühstoss), Natrii chloridum, Acidum hydrochloridum 25 %, Aqua purificata ad sol.
Indikationen/AnwendungsmöglichkeitenMiacalcic Nasenspray ist indiziert zur Behandlung von:
Osteoporoseprävention
Bei akutem Knochenschwund aufgrund plötzlicher Immobilisierung wie zum Beispiel bei Patienten mit Osteoporose-Frakturen (siehe «Eigenschaften/Wirkungen») Miacalcic soll je nach individuellem Bedarf des Patienten zusammen mit Calcium und Vitamin D in ausreichender Dosierung verabreicht werden, um einen weiteren Verlust an Knochenmasse zu verhindern. Behandlungsdauer maximal 3 Monate.
Morbus Paget (Osteitis deformans):
Nur bei Patienten, die nicht auf alternative Behandlungen ansprechen oder bei denen alternative Behandlungen ungeeignet sind; Therapiedauer generell 3 Monate (s. auch «Dosierung/Anwendung»).
Algodystrophie oder Sudeck-Syndrom (Neurodystrophische Störungen):
Neurodystrophische Störungen aufgrund unterschiedlicher ätiologischer und prädisponierender Faktoren wie posttraumatische schmerzhafte Osteoporose, Reflexdystrophie, Schulter-Arm-Syndrom, Kausalgie und arzneimittelbedingte neurotrophische Störungen. Therapiedauer bis 6 Wochen.
Dosierung/AnwendungEs wird empfohlen, die einzelnen Spraystösse des Nasensprays alternierend in beide Nasenöffnungen zu verabreichen (siehe Gebrauchsanweisung am Ende der Fachinformation). Im Vergleich zu den Calcitonin-Ampullen ist die Bioverfügbarkeit des Nasensprays mit bis zu 25% deutlich geringer, während mit der Injektionslösung eine Bioverfügbarkeit um 70% erreicht wird.
Aufgrund eines Zusammenhangs des langfristigen Einsatzes von Calcitonin und des Auftretens maligner Erkrankungen (siehe Abschnitt «Warnhinweise und Vorsichtsmassnahmen»), sollte die Behandlung mit Calcitonin bei allen Indikationen auf die kürzeste mögliche Zeit mit der niedrigsten effektiven Dosis beschränkt werden.
Übliche Dosierung / Therapiedauer
Osteoporose
200 I.E. (= 2 Spraystösse von Miacalcic mite 100 oder 1 Spraystoss von Miacalcic 200)/d, eventuell auf mehrere Einzeldosen verteilt.
Die Bioäquivalenz von 1× 200 I.E. und 2× 100 I.E. wurde nicht geprüft, die Daten klinischer Studien belegen jedoch die Wirksamkeit beider Dosierungen.
Morbus Paget
Bei Morbus Paget beträgt die empfohlene Dosis 200 I.E./Tag (= 2 Spraystösse von Miacalcic mite 100) verteilt auf 2 Anwendungen pro Tag. In einigen wenigen Fällen können am Anfang der Therapie 2× 200 I.E./Tag erforderlich sein. Im Laufe der Behandlung kann auch mit dieser Applikationsform eine Dosisreduktion angestrebt werden.
Die Behandlungsdauer hängt von der therapeutischen Indikation und dem Ansprechen des Patienten ab. Ausnahmsweise (bei Kontraindikationen von Bisphosponaten, schwerer Niereninsuffizienz oder pathologische Frakturen) kann bis 6 Monate behandelt werden. Danach ist eine weitere Therapie nur nach engmaschiger Nutzenrisiko-Beurteilung (Tumorrisiko) zulässig.)
Algodystrophie (Neurodystrophische Störungen)
Die Diagnose von neurodystrophischen Störungen sollte frühzeitig gestellt und nach deren Bestätigung sofort mit der Behandlung begonnen werden.
Die empfohlene Dosis beträgt 200 I.E./Tag in 2 Einzeldosen während 2 bis 4 Wochen. Anschliessend können 3× 200 I.E. pro Woche bei einer Behandlungsdauer von bis zu 6 Wochen, je nach klinischem Ansprechen verabreicht werden.
Spezielle Dosierungsanweisungen
Spezielle Hinweise
Die alkalische Phosphatase im Serum und die Hydroxyprolin-Ausscheidung im Urin werden durch die Behandlung mit Miacalcic deutlich gesenkt, häufig sogar normalisiert. Die Schmerzen gehen völlig oder teilweise zurück.
In seltenen Fällen steigt die alkalische Phosphatase und Hydroxyprolin-Ausscheidung nach anfänglicher Senkung wieder an; in diesen Fällen muss der Arzt aufgrund des klinischen Bildes über die Weiterführung der Therapie entscheiden.
Einen bis mehrere Monate nach Absetzen von Miacalcic kann es erneut zu Störungen des Knochenstoffwechsels kommen, die einen erneuten Behandlungszyklus mit Miacalcic erforderlich machen.
Bei einigen Patienten können während der Langzeitbehandlung mit Calcitonin Antikörper gegen Calcitonin auftreten. Die klinische Wirksamkeit wird in der Regel jedoch nicht beeinflusst. Anzeichen von Wirkungsverlust («Escape»-Phänomen), die manchmal bei Langzeit-Therapie von Paget-Patienten beobachtet werden, beruhen wahrscheinlich auf einer Sättigung der Rezeptoren und stehen offenbar in keinem Zusammenhang mit der Entstehung von Antikörpern. Nach einem Therapieunterbruch spricht der Patient erneut auf Miacalcic an.
Bei Langzeitbehandlung mit dem Nasenspray wurden keine pathologischen Veränderungen der Nasenschleimhaut beobachtet.
Ältere Patienten / besondere Patientengruppen
Umfangreiche Erfahrungen mit der Anwendung von Miacalcic bei älteren Patienten haben keine Hinweise auf eine geringere Verträglichkeit oder die Notwendigkeit einer Dosisanpassung ergeben. Dasselbe gilt für Patienten mit eingeschränkter Leber- oder Nierenfunktion, obgleich in dieser Population keine speziellen Studien durchgeführt worden sind.
Kinder und Jugendliche
Miacalcic soll Kindern höchstens für einige Wochen verabreicht werden, sofern der Arzt eine längere Behandlungsdauer nicht für zwingend notwendig erachtet. Zur Langzeitbehandlung von Kindern liegen keine ausreichenden Erfahrungen vor.
KontraindikationenBekannte Überempfindlichkeit auf synthetisches Salmcalcitonin oder auf einen der Hilfsstoffe (s. «Warnhinweise und Vorsichtsmassnahme» und «Unerwünschte Wirkungen»).
Warnhinweise und VorsichtsmassnahmenAllergische Reaktionen
Da Salmcalcitonin ein Polypeptid ist, besteht die Möglichkeit von allergischen Reaktionen. Reaktionen vom allergischen Typ einschliesslich einzelner Fälle von anaphylaktischem Schock sind bei Patienten unter Miacalcic beobachtet worden. Bei Patienten mit vermuteter Überempfindlichkeit auf Calcitonin ist vor Einleitung der Behandlung ein Hauttest mit einer verdünnten sterilen Lösung von Miacalcic Ampullen zu erwägen.
Risiko maligner Erkrankungen
Metaanalysen von randomisierten, kontrollierten Studien bei Patienten mit Osteoarthritis und Osteoporose haben gezeigt, dass der Einsatz von Calcitonin im Vergleich zu Placebo langfristig mit einer kleinen, aber statistisch signifikanten Erhöhung der Inzidenz maligner Erkrankungen (siehe Abschnitt «Unerwünschte Wirkungen») verbunden ist. Patienten in den Studien wurden mit oralen oder intranasalen Formulierungen behandelt. Die Meta-Analysen zeigten einen Anstieg in der absoluten Rate des Auftretens von Tumoren bei Patienten mit Calcitonin im Vergleich zu Placebo, die zwischen 0,7% (orale Formulierung) und 2,36% (Nasenspray) variierte. Numerische Ungleichgewichte zwischen Calcitonin und Placebo wurden nach 6 bis 12 Monaten der Therapie beobachtet. Ein Mechanismus für die Beobachtung konnte nicht identifiziert werden. Die Vorteile für den individuellen Patienten sollten sorgfältig gegen mögliche Risiken abgewogen werden (siehe Abschnitt «Unerwünschte Wirkungen»).
Dieses Arzneimittel enthält 0.009 mg Benzalkoniumchlorid pro Sprühstoss.
Benzalkoniumchlorid kann eine Reizung oder Schwellung der Nasenschleimhaut hervorrufen, insbesondere bei längerer Anwendung.
InteraktionenBei gleichzeitiger Anwendung von Calcitonin und Lithium kann es zu einer Abnahme der Plasmakonzentration von Lithium bis zu 30% kommen. Eventuell ist eine Dosisanpassung von Lithium erforderlich.
Schwangerschaft, StillzeitFrauen im gebärfähigen Alter
Es gibt keine Angaben, welche spezielle Empfehlungen für Frauen im gebärfähigen Alter nahelegen.
Schwangerschaft
Reproduktionsstudien bei Tieren haben gezeigt, dass Miacalcic kein embryotoxisches oder teratogenes Potential besitzt. Aber man verfügt über keine kontrollierten Studien und es gibt ungenügende, dokumentierte Erfahrung mit Miacalcic Nasenspray bei schwangeren Frauen. Aus diesem Grund sollte Miacalcic während der Schwangerschaft mit Vorsicht angewendet werden.
Stillzeit
Da es ungenügende, dokumentierte Erfahrung mit Miacalcic Nasenspray bei stillenden Müttern gibt, wird vom Stillen während der Behandlung abgeraten. Es ist nicht bekannt, ob Miacalcic in die Muttermilch übertritt.
Fertilität
Es gibt keine Daten zur möglichen Auswirkung von Miacalcic auf die menschliche Fertilität.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenEs gibt keine Untersuchungen zur Wirkung auf die Fahrtüchtigkeit und das Bedienen von Maschinen. Miacalcic kann vorübergehend Müdigkeit, Schwindel und Sehstörungen hervorrufen, wodurch die Reaktionsfähigkeit des Patienten beeinträchtigt werden könnte. Die Patienten müssen daher auf die Möglichkeit des Auftretens dieser Effekte hingewiesen werden. In diesem Fall dürfen die Patienten weder ein Fahrzeug lenken noch eine Maschine bedienen.
Unerwünschte WirkungenListe der unerwünschten Wirkungen
Die unerwünschten Wirkungen sind nach MedDRA-Systemorganklassen und Häufigkeit gemäss folgender Konvention geordnet:
„sehr häufig“ (≥1/10)
„häufig“ (≥1/100, <1/10)
„gelegentlich“ (≥1/1‘000, <1/100)
„selten“ (≥1/10‘000, <1/1‘000)
„sehr selten“ (<1/10‘000) einschliesslich isolierte Fälle
bei Postmarketing: Häufigkeit unbekannt.
Erkrankungen des Immunsystems
Selten: Überempfindlichkeit.
Sehr selten: Anaphylaktische und anaphylaktoide Reaktionen, anaphylaktischer Schock.
Stoffwechsel- und Ernährungsstörungen
Häufigkeit nicht bekannt: Hypokalzämie.
Erkrankungen des Nervensystems
Häufig: Kopfschmerzen, Schwindel, Störung des Geschmackempfindens.
Häufigkeit nicht bekannt: Tremor.
Augenerkrankungen
Gelegentlich: Sehschwäche.
Herzerkrankungen/Gefässerkrankungen
Häufig: Errötung (Flushing).
Gelegentlich: Hypertonie.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Sehr häufig: Nasenbeschwerden, verstopfte Nase, Nasenödem, Niesen, Rhinitis, trockene Nase, allergische Rhinitis, nasale Irritation, nasaler Geruch, Erythem der Nasenschleimhaut, Mukosa- Abschürfung.
Häufig: Epistaxis, Sinusitis, ulzerative Rhinitis, Pharyngitis.
Gelegentlich: Husten.
Erkrankungen des Gastrointestinaltrakts
Häufig: Übelkeit, Diarrhöe, Abdominalschmerzen.
Gelegentlich: Erbrechen.
Erkrankungen der Haut und des Unterhautgewebes
Selten: generalisierter Hautausschlag.
Skelettmuskulatur-, Bindegewebs und Knochenerkrankungen
Häufig: Gelenkschmerzen.
Gelegentlich: Muskelskelettschmerzen.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufig: Müdigkeit.
Gelegentlich: Grippeähnliche Symptome, Ödem (im Gesicht, an den Extremitäten oder generalisiert).
Selten: Pruritus.
Spezialpopulationen
Metaanalysen randomisierter, kontrollierter Studien bei Patienten mit Osteoarthritis und Osteoporose haben gezeigt, dass die Behandlung mit Calcitonin im Vergleich zu Plazebo langfristig mit einer kleinen, aber statistisch signifikanten Zunahme der Inzidenz maligner Erkrankungen verbunden ist. Ein Mechanismus für diese Beobachtung konnte nicht identifiziert werden (siehe Abschnitt «Warnhinweise und Vorsichtsmassnahmen»).
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungAnzeichen und Symptome
Bei parenteraler Verabreichung können dosisabhängig Übelkeit, Erbrechen, Flush und Schwindel auftreten. Es kann deshalb erwartet werden, dass solche Effekte auch bei einer Überdosierung mit Miacalcic Nasenspray auftreten. Miacalcic Nasenspray wurde jedoch bis zu einer Einzeldosis von 1600 I.E. und bis zu 800 I.E. pro Tag während 3 Tagen verabreicht, ohne dass schwerwiegende unerwünschte Wirkungen aufgetreten wären. Es wurde über einzelne Fälle von Überdosierung berichtet.
Behandlung
Die Behandlung erfolgt symptomatisch.
Eigenschaften/WirkungenATC-Code
H05BA01
Wirkungsmechanismus/Pharmakodynamik
Alle Calcitonine bestehen aus einer Kette von 32 Aminosäuren mit einem Ring am N-Ende aus 7 Aminosäuren mit nach Spezies unterschiedlicher Sequenz. Salmcalcitonin wirkt aufgrund seiner höheren Affinität für die Rezeptorenbindungsstellen stärker und länger als Calcitonin von Säugetieren.
Salmcalcitonin hemmt die Aktivität der Osteoklasten über deren spezifische Rezeptoren und führt bei gesteigerter Knochenresorption wie beispielsweise bei der Osteoporose zu einer markanten Reduktion bis hin zur Normalisierung des Knochenumsatzes. Im Tiermodell und beim Menschen wurde gezeigt, dass Salmcalcitonin, vermutlich durch direkte Beeinflussung des zentralen Nervensystems, eine analgetische Wirkung hat.
Klinische Wirksamkeit
Miacalcic bewirkt beim Menschen bereits nach Applikation einer einzigen Dosis eine klinisch relevante biologische Response. Diese manifestiert sich durch erhöhte Ausscheidung von Calcium, Phosphor und Natrium im Urin (durch Reduktion der tubulären Rückresorption) und reduzierte Ausscheidung von Hydroxyprolin im Urin.
Kontrollierte Studien an kleineren Patienten-Kollektiven mit Miacalcic Nasenspray haben gezeigt, dass es zu einer signifikanten Reduktion der Marker des Knochen-Turnovers wie Serum C-Telopeptide (sCTX), Osteocalcin und skelettaler Isoenzyme der alkalischen Phosphatase kommt, zumindest für die ersten 3 Monate.
Miacalcic entfaltet insbesondere bei postmenopausalen Frauen mit hohem Knochen-Turnover günstige Effekte mit einer knochenstabilisierenden Wirkung, nebst der Analgesie, welche vor allem bei osteoporotischen Frakturen von Vorteil ist.
Eine Mitte 2011 publizierte Meta-Analyse, welche auf Schmerzbekämpfung nach Wirbel-Kompressionsfrakturen fokussiert war (Daten mit Nasenspray + Ampullen), fand signifikante Effekte für Calcitonin im Vergleich zu Placebo in den ersten 4 Wochen im Ruhezustand. Bei mobilen Gruppen war auch noch nach 6 Monaten ein kleiner (aber statistisch signifikanter) Effekt vorhanden.
In einem Kollektiv von 467 Patienten (10 Studien) war das Durchnittsalter um 67 Jahre und 90% waren Frauen; diese Daten zeigen also, dass die Wirksamkeit vor allem bei postmenopausalen Frauen gezeigt ist, während die Anwendung bei Männern und jüngeren Patienten nur beschränkt dokumentiert ist.
Calcitonin hemmt die Magen- und exokrine Pankreassekretion.
PharmakokinetikIntranasale Verabreichung
Von verschiedenen Autoren werden unterschiedliche Daten zur Bioverfügbarkeit angegeben, sie dürfte bei maximal 25% liegen. Wie bei anderen Polypeptidhormonen auch, ist der Plasmaspiegel von Salmcalcitonin nicht prädiktiv für die therapeutische Wirkung.
Absorption
Keine Daten vorhanden.
Distribution
Keine Daten vorhanden.
Metabolismus
Keine Daten vorhanden.
Elimination
Keine Daten vorhanden.
Präklinische DatenDie tägliche intranasale Verabreichung einer Placebo-Lösung mit 0.01% Benzalkoniumchlorid oder hohen Dosen einer Calcitonin Formulierung mit 0.01% Benzalkoniumchlorid während 26 Wochen wurde von Affen gut vertragen. Es wurden keine behandlungsbedingten Veränderungen im Respirationstrakt beobachtet. Die tägliche intranasale Verabreichung von Salmcalcitonin mit 0.01% Benzalkoniumchlorid an Hunden während 4 Wochen zeigte keine relevanten abnormen Befunde in der Nasenhöhle oder im oberen Respirationstrakt. Miacalcic Nasenspray mit 0.01% Benzalkoniumchlorid veränderte nicht die nasale Ziliarschlagfrequenz des Meerschweinchens nach 4-wöchiger Behandlung oder des Paget Patienten nach 6-monatiger Behandlung.
Sicherheitspharmakologie
Präklinische in-vivo-Daten zur Sicherheit weisen auf keinen Zusammenhang einer Lachs-Calcitonin-Behandlung mit malignen Erkrankungen und bieten keine Belege für eine Tumorprogression.
Toxizität bei wiederholter Gabe
Toxikologische Befunde aus Langzeituntersuchungen sind der pharmakologischen Wirkung von Salmcalcitonin zuzuschreiben. Salmcalcitonin besitzt weder ein embryotoxisches, teratogenes noch mutagenes Potenzial. Toxizitäts- und Kanzerogenitätsstudien in Ratten haben gezeigt, dass Salmcalcitonin die Inzidenz für Hypophysentumoren erhöht.
Kanzerogenität
Weitere präklinische Studien, insbesondere eine Maus-Karzinogenitätsstudie, in welcher die maximale Exposition mehr als 7000mal höher war als beim Menschen nach einer Dosis von 200 I.E., lassen annehmen, dass diese erhöhte Inzidenz für Hypophysentumoren speziesspezifisch für Ratten ist.
Sonstige HinweiseHaltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit „EXP“ bezeichneten Datum verwendet werden.
Haltbarkeit nach Anbruch
Angebrochene Spraybehälter: Aufrecht stehend bei Raumtemperatur (15-25 °C) lagern und innerhalb max. 4 Wochen verbrauchen.
Besondere Lagerungshinweise
Nicht angebrochene Spraybehälter: Im Kühlschrank (2-8°C) lagern.
Nicht einfrieren.
Ausser Reichweite von Kindern aufbewahren.
Hinweise für die Handhabung
Ausführliche Hinweise zur Anwendung sind am Ende der Fachinformation nach der Rubrik «Stand der Information» aufgeführt.
Zulassungsnummer47473 (Swissmedic).
PackungenMiacalcic mite 100, Nasenspray
1 Flasche mit mindestens 1400 I.E.: 1. [B]
Miacalcic 200, Nasenspray
1 Flasche mit mindestens 2800 I.E.: 1. [B]
ZulassungsinhaberinFuture Health Pharma GmbH, 8620 Wetzikon ZH.
Stand der InformationJanuar 2023
Gebrauchsanweisung
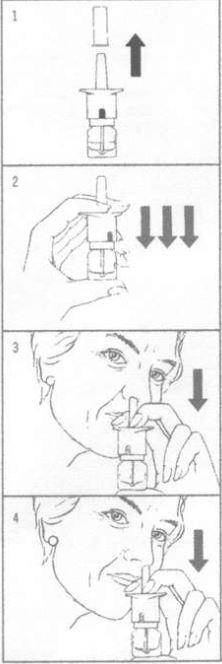
1.Die Schutzkappe entfernen (Abb. 1).
2.Nur bei erstmaliger Ingebrauchnahme: Den Nasenspray wie abgebildet halten (Abb. 2), die Dosierpumpe kräftig nach unten drücken, bis ein «Klick» zu hören ist, und wieder loslassen. Dies sollte zweimal wiederholt werden. Nach dem ersten Mal zeigt das Fenster des Dosiszählers weisse und rote Markierungen, nach dem zweiten Mal weisse und nach dem dritten Mal grüne. Bei Erscheinen der grünen Markierung am unteren Ende der Dosierpumpe ist der Nasenspray gebrauchsfertig.
3.Den Kopf leicht nach vorne neigen und den Sprühkopf in eine Nasenöffnung so einführen, dass sich der Sprühnebel gleichmässig verteilen kann, d.h. die Düsenöffnung sollte nicht gegen die Nasenwand gerichtet sein. Die Dosierpumpe EINMAL (rasch und kräftig) herunterdrücken und wieder loslassen (s. Abb. 3). Im Fenster der Zählerscheibe erscheint die Ziffer 1.
4.Nach der Anwendung mehrmals kräftig durch die Nase einatmen, um ein Herauslaufen der Lösung aus der Nase zu verhindern. Nicht unmittelbar nach der Anwendung die Nase putzen.
5.Wurde mehr als eine Dosis gleichzeitig verordnet, ist ein weiterer Sprühstoss gemäss Punkt 3 und 4 in die andere Nasenöffnung zu applizieren (s. Abb. 4).
6.Nach Gebrauch die Schutzkappe wieder aufsetzen, um ein Verstopfen der Düse zu verhindern.
7.Das Nasenspray gewährleistet 14 abgemessene Dosen. Möglicherweise können zwei weitere Dosen entnommen werden. Sobald 14 Sprühstösse entnommen sind, erscheint eine schwarze «15» und anschliessend eine rote «16» im Fenster der Zählerscheibe und ein spürbarer Widerstand erschwert die weitere Betätigung der Dosierpumpe (Warnstop). Ein Rest (Überfüllung aus technischen Gründen) bleibt in der Flasche zurück. Wird die Dosierpumpe trotzdem weiter betätigt, kann eine ausreichende Dosierung nicht mehr gewährleistet werden.
8.Sollte die Pumpvorrichtung einmal verstopft sein, versuchen Sie, die Verstopfung durch einen forcierten Sprayhub zu beheben. Die Düse nicht mit einem spitzen Gegenstand manipulieren, da deren Funktion dadurch zerstört wird. Die Pumpe nicht auseinandernehmen. Aufrecht lagern oder transportieren, um eine gleichmässige Dosierung zu gewährleisten. Schütteln und extreme Temperaturen vermeiden.
| 
