ZusammensetzungWirkstoffe
Dornasum alfa.
Rekombinante humane Desoxyribonuklease I (rhDNase), gentechnologisch in Ovarialzellen des chinesischen Hamsters hergestellt, bestehend aus einem aktiven Gemisch von DNase und Desamido-DNase (Spezifikation: 65 ± 17% Desamido-DNase).
Hilfsstoffe
Natrii chloridum, calcii chloridum dihydricum, aqua ad iniectabile.
Indikationen/AnwendungsmöglichkeitenZur symptomatischen Behandlung in Kombination mit einer Standardtherapie der zystischen Fibrose (Mukoviszidose) bei Patienten mit einer forcierten Vitalkapazität (FVC) von mehr als 40% des Normwerts.
Zurzeit liegen Erfahrungen bei Patienten ab 5 Jahren während einer Behandlungsdauer von maximal 2 Jahren vor.
Eine Langzeitanwendung von Pulmozyme ist angezeigt zur Verhinderung der respiratorischen Komplikationen, die durch Anhäufung von DNA im infizierten Mucus entstehen, der sich bei zystischer Fibrose (Mukoviszidose) in den Luftwegen ansammelt. Eine solche Langzeitbehandlung bewirkt:
·eine Verminderung wiederholt auftretender symptomatischer Infektionen, die eine parenterale Behandlung des Patienten mit Antibiotika und stationäre Behandlung erfordern;
·eine Verbesserung der Atemfunktion und eine Milderung der Symptome, wie Kurzatmigkeit, Husten und Schleimansammlungen;
·eine Verbesserung des Allgemeinbefindens des Patienten.
Dosierung/AnwendungÜbliche Dosierung
Für Patienten mit zystischer Fibrose empfiehlt sich eine Dauerbehandlung mit täglich 2,5 mg Dornase alfa, d.h. eine Inhalation mit dem unverdünnten Inhalt einer Ampulle zu 2,5 ml Lösung täglich (siehe «Hinweise für die Handhabung»).
Bei einzelnen Patienten über 21 Jahre kann die 2-mal tägliche Verabreichung einer Tagesdosis vorteilhaft sein.
Spezielle Dosierungsanweisungen
Um die Rückverfolgbarkeit von biotechnologisch hergestellten Arzneimitteln bei Auftreten unerwünschter Ereignisse sicherzustellen, sind der Handelsname und die Chargen-Nummer bei jeder Behandlung zu dokumentieren.
Kinder und Jugendliche
Zur Anwendung bei Patienten, die jünger als 5 Jahre sind liegen nur begrenzte Erfahrungen vor. Pharmakokinetischen und prospektiven Beobachtungsstudien nach der Markteinführung zufolge ist die Verabreichung von Pulmozyme an Kindern unter 5 Jahren in der gleichen Dosis wie für ältere Kinder unter Verwendung einer Gesichtsmaske sicher. Eine solche Anwendung sollte aber nur in Betracht gezogen werden, wenn ein potenzieller Nutzen in Bezug auf die Lungenfunktion sowie auf das Risiko von Atemwegsinfektionen besteht (siehe «Unerwünschte Wirkungen»).
Die Wirksamkeit und Langzeitsicherheit sind in dieser Altersgruppe nicht belegt.
Art der Anwendung
Der optimale Nutzen wird bei der Mehrzahl der Patienten mit einer regelmässigen täglichen Anwendung von Pulmozyme erzielt. Studien, in denen Pulmozyme intermittierend verabreicht wurde, zeigen, dass die Besserung der Lungenfunktion innerhalb weniger Tage nach Absetzen der Therapie wieder abnimmt. Ausschliesslich bei täglicher und dauernder Anwendung konnte in klinischen Studien gezeigt werden, dass die Häufigkeit der Exazerbationen von Atemwegsinfektionen zurückgeht. Aus diesen Gründen sollten die Patienten angewiesen werden, das Präparat täglich anzuwenden.
Während der Therapie mit Pulmozyme sollte die gewohnte medizinische Behandlung des Patienten, einschliesslich des physiotherapeutischen Standard-Programms zur Verbesserung der Atemfunktion, weitergeführt werden.
Patienten, bei denen während der Therapie mit Pulmozyme eine Exazerbation einer Atemwegsinfektion auftritt, können die Anwendung von Pulmozyme unbedenklich fortsetzen. Die Patienten sollen ihre Physiotherapie zur Verbesserung der Atemfunktion fortsetzen.
Bei Patienten, deren forcierte Vitalkapazität weniger als 40% des Normwerts beträgt, sind Wirksamkeit und Unbedenklichkeit der Anwendung von Pulmozyme bisher noch nicht in klinischen Studien nachgewiesen worden.
KontraindikationenPulmozyme darf nicht an Patienten mit bekannter Überempfindlichkeit gegen den Wirkstoff oder weitere Bestandteile des Präparates verabreicht werden.
Warnhinweise und VorsichtsmassnahmenEs sind keine besonderen Vorsichtsmassnahmen zu berücksichtigen.
InteraktionenStandardtherapeutika der zystischen Fibrose, z.B. Antibiotika, Bronchodilatatoren, Pankreasenzympräparate, Vitamine, Kortikosteroide (sowohl zur Inhalation als auch systemisch angewendet) und Analgetika können unbedenklich zusammen mit Pulmozyme verwendet werden. Pulmozyme darf jedoch im Inhalationsgerät (Vernebler) nicht mit solchen Präparaten gemischt werden (siehe «Sonstige Hinweise – Inkompatibilitäten»).
Schwangerschaft, StillzeitSchwangerschaft
Die Unbedenklichkeit einer Anwendung von Dornase alfa während der Schwangerschaft ist nicht belegt. Studien bei Tieren ergaben keinen Hinweis auf direkte oder indirekte schädliche Auswirkungen bezüglich Trächtigkeit oder Entwicklung des Embryos oder Fetus (siehe «Präklinische Daten»), aber man verfügt über keine kontrollierten Studien bei schwangeren Frauen. Bei der Anwendung in der Schwangerschaft ist daher Vorsicht geboten.
Stillzeit
Wenn Dornase alfa den Dosierungsempfehlungen entsprechend an Patienten verabreicht wird, kommt es zu einer minimalen systemischen Absorption; daher sind keine messbaren Konzentrationen von Dornase alfa in der Muttermilch zu erwarten. Trotzdem ist Vorsicht geboten, wenn Dornase alfa an stillende Frauen verabreicht wird (siehe «Absorption» und «Präklinische Daten»).
In einer Studie mit laktierenden Cynomolgus-Affen, bei der hohe Dosen von Dornase alfa intravenös verabreicht wurden, konnten in der Milch nur niedrige Konzentrationen (<0,1% der im Serum trächtiger Cynomolgus-Affen gemessenen Konzentrationen) gemessen werden.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenEs liegen keine Berichte über die Auswirkungen auf die Fahrtüchtigkeit und die Fähigkeit zum Bedienen von Maschinen vor.
Unerwünschte WirkungenDie Auflistung der Häufigkeitskategorien erfolgt unter Berücksichtigung der MedDRA Terminologie: Sehr häufig (≥ 1/10), häufig (≥ 1/100 bis <1/10), gelegentlich (≥ 1/1‘000 bis <1/100), selten (≥ 1/10‘000 bis <1/1‘000), sehr selten (<1/10‘000).
In den meisten Fällen sind die unerwünschten Wirkungen leicht und vorübergehend und erfordern keine Änderung der Dosierung.
Augenerkrankungen
Häufig: Konjunktivitis.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Sehr häufig: Dysphonie, Pharyngitis, Rhinitis (alle nicht infektiös).
Häufig: Laryngitis (nicht infektiös).
Gelegentlich: Dyspnoe (nicht infektiös).
Erkrankungen des Gastrointestinaltrakts
Gelegentlich: Dyspepsie.
Erkrankungen der Haut und des Unterhautgewebes
Sehr häufig: Ausschlag, Urtikaria.
Allgemeine Störungen und Beschwerden am Verabreichungsort
Sehr häufig: Thoraxschmerz (pleuritisch, nicht kardial)
Gelegentlich: Fieber.
Untersuchungen
Gelegentlich: Erniedrigter Lungenfunktionstest.
Folgende unerwünschte Wirkungen traten in placebokontrollierten Doppelblindstudien auf:
|
Unerwünschte Wirkungen
|
Placebo
(n = 325)
|
1× 2,5 mg/d
(n = 322)
|
2× 2,5 mg/d
(n = 321)
| |
Augenerkrankungen
| |
Konjunktivitis
|
2%
|
4%
|
5%
| |
Erkrankungen der Atemwege, des Brustraums und Mediastinums
| |
Pharyngitis
|
33%
|
36%
|
40%
| |
Veränderung der Stimme
|
7%
|
12%
|
16%
| |
Laryngitis
|
1%
|
3%
|
4%
| |
Erkrankungen der Haut und des Unterhautgewebes
| |
Hautausschlag
|
7%
|
10%
|
12%
| |
Allgemeine Störungen und Beschwerden am Verabreichungsort
| |
Thorakaler Schmerz
|
16%
|
18%
|
21%
|
Wie der hohe Anteil von Patienten zeigt, die an den klinischen Prüfungen mit Pulmozyme bis zu deren Ende teilgenommen haben, können Patienten, die an den bei zystischer Fibrose üblichen Begleitbeschwerden leiden, in der Regel die Anwendung von Pulmozyme unbedenklich fortsetzen.
In klinischen Studien litten wenig Patienten an Begleitbeschwerden, die den Abbruch der Behandlung mit Dornase alfa erforderten. Die beobachtete Absetzrate war zwischen Placebo (2%) und Dornase alfa (3%) vergleichbar.
Bei Beginn der Behandlung mit Dornase alfa kann es, wie bei jedem Aerosol, zu einer Verschlechterung der Lungenfunktion und zu einem vermehrten Abhusten von Sputum kommen.
Bei weniger als 5% der Patienten entwickelten sich Antikörper gegen Dornase alfa. Keiner dieser Patienten wies IgE-Antikörper gegen Dornase alfa auf. Auch nach dem Auftreten von Antikörpern gegen Dornase alfa konnte eine Verbesserung der Ergebnisse von Lungenfunktionsprüfungen erzielt werden.
Kinder unter 5 Jahren
In einer pharmakokinetischen Studie, in der 65 Kinder unter 5 Jahren sowie 33 Kinder im Alter von 5–9 Jahren einmal täglich 2,5 mg Pulmozyme während 14 Tagen erhielten, konnte zwischen den beiden Altersgruppen kein klinisch relevanter Unterschied in Bezug auf das Nebenwirkungsprofil von Pulmozyme beobachtet werden (siehe «Pharmakokinetik spezieller Patientengruppen»).
Die prospektive Beobachtung von Kindern unter 5 Jahren, die sowohl nach der Behandlung mit Pulmozyme als auch während der behandlungsfreien Phase erfolgte, ergab keinen Anstieg schwerer unerwünschter Wirkungen während der Verabreichung von Pulmozyme.
Pulmozyme sollte nur an Patienten unter 5 Jahren verabreicht werden, wenn ein potenzieller Nutzen in Bezug auf die Lungenfunktion oder auf das Risiko von Atemwegsinfektionen besteht.
Unerwünschte Wirkungen nach Markteinführung
Spontane Meldungen nach der Markteinführung sowie prospektiv gesammelte Sicherheitsdaten aus Beobachtungsstudien bestätigen das in den klinischen Studien beschriebene Sicherheitsprofil.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungEine Überdosierung mit Pulmozyme ist nicht bekannt. Patienten mit zystischer Fibrose inhalierten bis zu 20 mg Pulmozyme zweimal täglich (das sechzehnfache der empfohlenen Tagesdosis) über bis zu 6 Tage, und 10 mg zweimal täglich (das Achtfache der empfohlenen Tagesdosis) intermittierend (2 Wochen mit/2 Wochen ohne Therapie) über 168 Tage.
Eine systemische Toxizität von Pulmozyme wurde bis anhin nicht beobachtet, und ist angesichts der geringen Absorption und der kurzen Serumhalbwertzeit von Dornase alfa auch wenig wahrscheinlich.
Eigenschaften/WirkungenATC-Code
R05CB13
Wirkungsmechanismus
Rekombinante humane DNase ist die gentechnologisch hergestellte Form eines natürlicherweise beim Menschen vorkommenden Enzyms, welches extrazelluläre DNA spaltet.
Die Ansammlung von viskösen, eitrigen Sekreten in den Atemwegen trägt zu einer eingeschränkten Lungenfunktion und zum Aufflammen von Infektionen bei. Eitriges Sekret enthält sehr hohe Konzentrationen an extrazellulärer DNA, einem viskösen Polyanion, freigesetzt aus zerfallenden Leukozyten, die als Folge der Infektion verstärkt auftreten. In vitro hydrolysiert Dornase alfa DNA im Sputum und reduziert die Viskosität des Sputums von Patienten mit zystischer Fibrose erheblich.
Pharmakodynamik
Die in-vivo Inhalation von Dornase alfa verbessert die Lungenfunktion und senkt die Häufigkeit von akuten Exazerbationen bei zystischer Fibrose, indem die Atemwege besser von Sekreten und Schleim befreit werden.
Klinische Wirksamkeit
Pulmozyme wurde bei Patienten mit zystischer Fibrose im Alter von über 5 Jahren und bei unterschiedlicher Schwere der Lungenerkrankung untersucht. Die meisten Studien waren doppelblind und placebokontrolliert. Alle Patienten erhielten weitere Therapien nach Massgabe ihrer behandelnden Ärzte.
Patienten über 5 Jahre mit FVC >40% des Normwerts
Pulmozyme 2,5 mg einmal oder zweimal täglich, appliziert mittels eines Hudson T Up-draft II Verneblers mit Pulmo-Aide Kompressor, verminderte die Inzidenz eines ersten Atemwegsinfektes (Infektion, welche eine parenterale Antibiotikagabe erforderte) und verbesserte das durchschnittliche FEV1 (forciertes Expirationsvolumen in 1 Sekunde) im Vergleich zu Placebo.
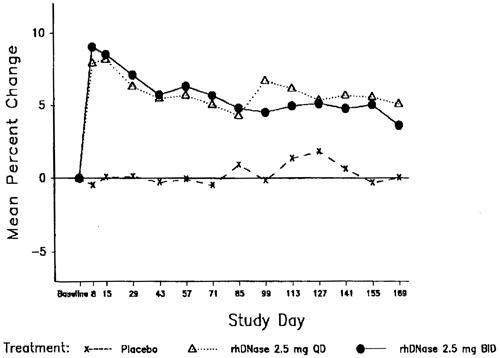
Pulmozyme reduzierte bei einmal täglicher resp. zweimal täglicher Gabe das relative Risiko einer Exazerbation einer Atemwegsinfektion um 27% resp. 29% (siehe Tabelle 1). Die Subanalyse der Daten deutet darauf hin, dass der Effekt von Pulmozyme auf Infektexazerbationen bei älteren Patienten (über 21 Jahre) möglicherweise kleiner ist, und dass bei diesen Patienten eine zweimal tägliche Dosierung nötig sein könnte. Patienten mit einer Ausgangs-FVC >85% profitieren eventuell ebenfalls von einer zweimal täglichen Dosierung (siehe Tabelle 1). Das reduzierte Risiko einer Infektexazerbation bei Patienten, die mit Pulmozyme behandelt wurden, hielt während der sechsmonatigen Studiendauer an und korrelierte nicht direkt mit einer Verbesserung des FEV1 während der ersten beiden Therapiewochen.
Tabelle 1: Inzidenz des Auftretens einer ersten Atemwegsinfektion, welche eine parenterale Antibiotikagabe erforderlich machte, in einer kontrollierten Studie
|
|
Placebo
n = 325
|
2,5 mg einmal täglich
n = 322
|
2,5 mg zweimal täglich
n = 321
| |
Prozentsatz der Patienten mit einer Infektion
|
43%
|
34%
|
33%
| |
relatives Risiko (vs. Placebo)
|
|
0,73
|
0,71
| |
p-Wert (vs. Placebo)
|
|
0,015
|
0,007
| |
Subgruppen nach Alter und Ausgangs-FVC
|
Placebo
(n)
|
2,5 mg einmal täglich
(n)
|
2,5 mg zweimal täglich
(n)
| |
Alter
| |
5-20 Jahre
|
42% (201)
|
25% (199)
|
28% (184)
| |
21 Jahre und älter
|
44% (124)
|
48% (123)
|
39% (137)
| |
Ausgangs-FVC
| |
40-85% des Normwerts
|
54% (194)
|
41% (201)
|
44% (203)
| |
>85% des Normwerts
|
27% (131)
|
21% (121)
|
14% (118)
|
Innerhalb der ersten acht Tage nach Beginn der Therapie mit Pulmozyme einmal resp. zweimal täglich, kam es verglichen mit dem Ausgangswert beim mittleren FEV1 zu einer Verbesserung um 7,9% resp. 9,0% verglichen mit dem Ausgangswert. Nach sechsmonatiger Therapie betrug die Verbesserung des FEV1 gegenüber dem Ausgangswert 5,8% resp. 5,6% bei einmal resp. zweimal täglicher Dosierung. Patienten, die Placebo erhielten, zeigten während der Studiendauer keine signifikanten Veränderungen in Lungenfunktionstests (siehe Abbildung 1).
Abbildung 1: Mittlere prozentuale Veränderung vom Ausgangs-FEV1 bei Patienten über 5 Jahre mit FVC >40% des Normwerts
Patienten unter 5 Jahren
Pharmakokinetische Daten einer Studie bei 65 Kindern im Alter von 3 Monaten bis 5 Jahre und 33 Kindern im Alter von 5–10 Jahren weisen darauf hin, dass mit der Verabreichung von 2,5 mg Pulmozyme mittels dem Pari Baby Vernebler und dem Proneb (= PariBoy) Kompressor ähnliche Konzentrationen von DNase in den Lungen von Patienten unter 5 Jahren erreicht werden wie mit dem Pari LC Plus Vernebler und demselben Kompressor in den Lungen von älteren Kindern, die auf eine Behandlung mit Pulmozyme ansprachen (siehe «Pharmakokinetik spezieller Patientengruppen»).
Zur Sicherheit in dieser Patientenpopulation siehe unter «Unerwünschte Wirkungen».
Studien zur klinischen Wirksamkeit wurden bei Patienten unter 5 Jahren nicht durchgeführt.
PharmakokinetikErgebnisse aus präklinischen Studien
Absorption
Inhalationsstudien bei Ratten und nicht-humanen Primaten ergaben, dass nur ein geringer Teil von Dornase alfa systemisch absorbiert wird (<15% bei Ratten und <2% bei Affen). In Übereinstimmung mit diesen tierexperimentellen Ergebnissen zeigt sich, dass Dornase alfa, das Patienten in Form eines Aerosols zur Inhalation verabreicht wird, eine nur geringfügige systemische Absorption erfährt.
Nach oraler Verabreichung an Ratten ist die Absorption von Dornase alfa aus dem Verdauungstrakt vernachlässigbar gering.
Distribution
Studien an Ratten und Affen haben gezeigt, dass Pulmozyme nach intravenöser Applikation rasch aus dem Serum eliminiert wird. In diesen Studien entsprach das initiale Verteilungsvolumen ungefähr dem Serumvolumen.
Metabolismus
Keine Angaben.
Elimination
Studien an Ratten weisen darauf hin, dass nach Verabreichung eines Aerosols die Dornase alfa mit einer Halbwertzeit von 11 Stunden aus den Lungen eliminiert wird.
Kinetik spezieller Patientengruppen
Derzeit sind keine pharmakokinetischen Daten von sehr jungen oder alten Tieren verfügbar.
Ergebnisse aus klinischen Studien
Absorption
DNase ist normalerweise im humanen Serum vorhanden. Die Inhalation von bis zu 40 mg Dornase alfa während einer Dauer von bis zu 6 Tagen führte nicht zu einem nennenswerten Anstieg der Serumkonzentration von Dornase alfa gegenüber den normalen körpereigenen Werten. Es wurde kein Anstieg der DNase-Konzentration, der höher als 10 ng/ml war, im Serum beobachtet. Nach einer Applikation von 2,5 mg Dornase alfa zweimal täglich über 24 Wochen unterschieden sich die durchschnittlichen DNase-Serumspiegel nicht von den durchschnittlichen Ausgangswerten (3,5 ± 0,1 ng/ml) vor der Therapie. Dies weist auf eine niedrige systemische Absorption oder Akkumulation hin (siehe unter «Präklinische Daten»).
Distribution
Bei Patienten mit zystischer Fibrose werden bei Inhalation von 2,5 mg Dornase alfa innerhalb von 15 Minuten durchschnittliche Spitzenkonzentrationen im Sputum von ca. 3 µg/ml Dornase alfa erreicht. Die Sputumkonzentration von Dornase alfa nimmt nach der Inhalation rasch ab.
Metabolismus
Es ist davon auszugehen, dass Dornase alfa von in den Körperflüssigkeiten vorhandenen Proteasen abgebaut wird.
Elimination
Intravenöse Studien an Menschen deuten auf eine Eliminationshalbwertzeit aus dem Serum von drei bis vier Stunden hin. Untersuchungen an Ratten und Affen haben ebenfalls gezeigt, dass DNase nach intravenöser Verabreichung schnell aus dem Serum eliminiert wird.
Nach Verabreichung eines Aerosols an Ratten wurde Dornase alfa mit einer Halbwertzeit von 11 Stunden aus den Lungen eliminiert.
Die Konzentrationen der DNase im Sputum fallen beim Menschen innert zwei Stunden auf weniger als die Hälfte der direkt nach Verabreichung gemessenen Werte. Die Effekte auf die Sputumrheologie halten hingegen länger als 12 Stunden an.
Pharmakokinetik spezieller Patientengruppen
Pulmozyme wurde in einer zweiwöchigen offenen Studie bei CF-Patienten zwischen 3 Monaten und 9 Jahren untersucht. Pulmozyme wurde in einer Dosis von 2,5 mg täglich mittels Inhalation an 98 Patienten verabreicht (davon 65 Patienten zwischen 3 Monaten und <5 Jahren sowie 33 Patienten zwischen 5 und <10 Jahren). Innerhalb von 90 Minuten nach Verabreichung der ersten Dosis wurde eine bronchoalveoläre Lavage (BAL) durchgeführt. Ein Pari Baby Vernebler (bei dem eine Gesichtsmaske statt eines Mundstücks benutzt wird) wurde bei den Patienten eingesetzt, die nicht in der Lage waren, während der gesamten Behandlung durch den Mund ein- und auszuatmen (54 von 65 [83%] der jüngeren und 2 von 33 [6%] der älteren Patienten). Die DNase-Konzentrationen die in der BAL-Spülflüssigkeit aller Patienten nachgewiesen wurden, waren jedoch über einen weiten Bereich gestreut (0,007 bis 1,8 µg/ml). Während der durchschnittlich 14-tägigen Behandlung stiegen die Serumkonzentrationen (Durchschnitt und Standardabweichung) der DNase in der Altersgruppe zwischen 3 Monaten und <5 Jahren um 1,1 ± 1,6 ng/ml und in der Altersgruppe zwischen 5 und <10 Jahren um 0,8 ± 1,2 ng/ml.
Präklinische DatenMutagenität
Im Ames-Test, im Maus-Lymphom-Test, in einem Chromosomen-Aberrationstest in kultivierten humanen peripheren Lymphozyten und im Maus-Mikronukleus-Test zeigte sich kein Anzeichen für ein genotoxisches Potential.
Karzinogenität
Eine 2-Jahres-Studie an Ratten ergab keinen Hinweis auf ein onkogenes Potenzial bei inhalativer Verabreichung.
Bei Gruppen von 60 Ratten je Geschlecht wurde Dornase alfa bis zu zwei Jahre lang in Dosen von 51, 101 oder 246 µg/kg/Tag in den unteren Respirationstrakt appliziert. Zwei gleich grosse Kontrollgruppen erhielten Luft bzw. Trägersubstanz. Dornase alfa war gut verträglich. Es kam nicht zum Auftreten ungewöhnlicher Tumore oder zu einem vermehrten Auftreten von Tumoren, welche auf eine Onkogenizität von Dornase alfa im Respirationstrakt oder anderen Organen oder Geweben der Ratte zurückzuführen wären.
Reproduktionstoxizität
Bei Ratten ergaben Studien mit Dornase alfa keinen Hinweis auf Fertilitätsstörungen, Teratogenität oder Entwicklungsstörungen.
Bei Kaninchen und Nagetieren ergaben Studien mit Dornase alfa keinen Hinweis auf Fertilitätsstörungen und Teratogenität.
Weitere Daten
Eine Studie bei laktierenden Cynomolgusaffen, die hohe intravenöse Dosen von Dornase alfa erhielten (100 µg/kg Bolus gefolgt von 80 µg/kg/Stunde für 6 Stunden), zeigte niedrige Konzentrationen (<0,1% der Serumkonzentration) in der Milch.
Eine vierwöchige Studie zur inhalativen Toxizität wurde bei juvenilen Ratten 22 Tage nach der Geburt mit Dosen von 0, 51, 102 und 260 µg/kg/Tag begonnen. Dornase alfa wurde gut vertragen. Im Respirationstrakt wurden keine Läsionen festgestellt.
Sonstige HinweiseInkompatibilitäten
Pulmozyme ist eine ungepufferte, wässrige Lösung und darf zur Inhalation weder verdünnt noch mit andern Arzneimitteln gemischt werden. Ein Vermischen der Lösung könnte zu unerwünschten strukturellen oder funktionellen Veränderungen von Pulmozyme wie auch des zugemischten Stoffes führen.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Im Kühlschrank (2-8 °C) lagern.
Den Behälter im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
Grössere Hitzeeinwirkung ist zu vermeiden. Einmalige kurzfristige Einwirkung erhöhter Temperatur auf die ungeöffnete Ampulle (bis zu 24 Stunden bei Temperaturen bis zu 30 °C) beeinträchtigt die Stabilität des Arzneimittels nicht; bei Verfärbung oder Trübung nicht mehr verwenden.
Haltbarkeit nach Anbruch
Pulmozyme enthält kein Konservierungsmittel; der Inhalt der Ampulle ist unmittelbar nach dem Öffnen auf einmal vollständig aufzubrauchen. Nicht aufgebrauchte Lösung soll vernichtet werden.
Hinweise für die Handhabung
Der Inhalt (2,5 mg) der Pulmozyme Kunststoffampulle zum einmaligen Gebrauch mit steriler Lösung für einen Vernebler soll einmal täglich mit Hilfe eines empfohlenen Verneblergerätes inhaliert werden.
Der Inhalt einer Ampulle Pulmozyme wird hierzu in die Kammer eines Vernebler-Systems, wie z.B. Hudson T Up-Draft II/Pulmo-Aide, Airlife Misty/Pulmo-Aide, individuell angepasstes Respirgard/Pulmo-Aide oder AcornII/Pulmo-Aide, gegeben.
Pulmozyme kann auch in Verbindung mit einem Inhalationsgerät, wie z.B. dem Pari LL/Inhalierboy, Pari LC/Inhalierboy oder Master, Aiolos/2 Aiolos, Side Stream/CR50, MobilAire oder Porta-Neb, verwendet werden, sowie mit dem Pari eRapid-Vernebler, einem elektronischen Universal-Vernebler, der auf einer Vibrationsmembrantechnologie beruht.
Patienten, die nicht in der Lage sind, während der gesamten Inhalationsdauer durch den Mund ein- oder auszuatmen, können den Pari Baby Vernebler mit einer Gesichtsmaske verwenden.
Ultraschall-Vernebler sind möglicherweise für die Applikation von Pulmozyme nicht geeignet, da Pulmozyme unter Umständen inaktiviert wird, oder die mit diesen Geräten erzielten Aerosole nicht-akzeptable Eigenschaften aufweisen.
Zu Gebrauch und Wartung der Inhalationsgeräte und Kompressoren sollen die jeweiligen Anweisungen des Herstellers beachtet werden.
Massnahmen zur Verhinderung des Austretens von Aerosol aus dem Inhalator in die Umgebung sind nicht erforderlich.
Pulmozyme Ampullen sind zur einmaligen Anwendung bestimmt.
Pulmozyme ist nicht zur Injektion oder zum Einnehmen bestimmt.
Zulassungsnummer52623 (Swissmedic).
PackungenAmpullen zu 2,5 mg/2,5 ml (1,0 mg/ml): 30 [B]
ZulassungsinhaberinRoche Pharma (Schweiz) AG, Basel.
Stand der InformationApril 2021.
|

