Eigenschaften/WirkungenATC-Code
C09DX04
Wirkungsmechanismus
Entresto enthält einen Salzkomplex, bestehend aus Sacubitril und Valsartan. LBQ657 ist der aktive Metabolit von Sacubitril und hemmt Neprilysin (neutrale Endopeptidase, NEP). Valsartan blockiert den Angiotensin-II-Typ-1 (AT1) Rezeptor. Die Kombination dieser beiden Hemmer wird als Angiotensin-Rezeptor-Neprilysin-Hemmer (ARNI) bezeichnet.
Die kardiovaskulären und die renalen Wirkungen von Entresto bei Patienten mit Herzinsuffizienz werden auf einen dualen Wirkmechanismus zurückgeführt: Einerseits kommt es über eine Hemmung des Abbaus zu einer Anreicherung von Peptiden (etwa natriuretische Peptide, NP) durch den Neprilysin-Hemmer LBQ657 und anderseits, durch Valsartan, zur gleichzeitigen Hemmung der schädlichen Wirkungen von Angiotensin II . NP wirken über eine Aktivierung der membrangebundenen Guanylylcyclase-gekoppelten Rezeptoren, was zu erhöhten Konzentrationen von zyklischem Guanosinmonophosphat (cGMP) als «second messenger» führt. Dies wiederum fördert eine Vasodilatation, Natriurese und Diurese, erhöht die glomeruläre Filtrationsrate und renale Durchblutung, hemmt die Renin- und Aldosteronfreisetzung, senkt die Sympathikusaktivität und induziert antihypertrophe und antifibrotische Wirkungen. Eine anhaltende Aktivierung des Renin-Angiotensin-Aldosteron-Systems führt zu Vasokonstriktion, renaler Natrium- und Flüssigkeitsretention, einer Aktivierung von Zellwachstum und -proliferation sowie in der Folge zu maladaptiven kardiovaskulären Remodeling-Prozessen. Valsartan hemmt die schädlichen kardiovaskulären und renalen Wirkungen von Angiotensin II durch selektive Blockade des AT1-Rezeptors und hemmt ausserdem die Angiotensin-II-abhängige Aldosteronfreisetzung.
Pharmakodynamik
Die pharmakodynamischen Wirkungen von Entresto wurden nach einmaliger und wiederholter Verabreichung bei gesunden Probanden und bei Patienten mit Herzinsuffizienz untersucht. Sie sind konsistent mit einer gleichzeitigen Neprilysinhemmung und RAAS-Blockade. Im Rahmen einer siebentägigen Valsartan-kontrollierten Studie bei Patienten mit verminderter Auswurffraktion (HFrEF) führte Entresto im Vergleich zu Valsartan zu einem signifikanten, nicht nachhaltigen Anstieg der Natriurese, erhöhtem cGMP im Urin und vermindertem MR-proANP und NT-proBNP im Plasm. Im Rahmen einer 21-tägigen Studie mit HFrEF-Patienten erhöhte Entresto verglichen mit Baseline das ANP und cGMP im Urin und das cGMP im Plasma und senkte das NT-proBNP, Aldosteron und Endothelin-1 im Plasma. Darüber hinaus blockierte Entresto den AT1-Rezeptor, was durch eine erhöhte Plasma-Renin-Aktivität und erhöhte Renin-Plasmaspiegel nachgewiesen wurde. Im Rahmen der Studie PARADIGM-HF senkte Entresto im Vergleich zu Enalapril das NT-proBNP im Plasma und erhöhte das BNP im Plasma und das cGMP im Urin. In der PANORAMA-HF-Studie wurde in den Wochen 4 und 12 für Sacubitril/Valsartan (40,2 % und 49,8 %) und Enalapril (18,0 % und 44,9 %) ein Rückgang des NT proBNP im Vergleich zum Ausgangswert beobachtet. Die NT proBNP-Werte sanken während der gesamten Studiendauer weiter, wobei in Woche 52 im Vergleich zum Ausgangswert ein Rückgang von 65,1 % für Sacubitril/Valsartan und 61,6 % für Enalapril zu verzeichnen war. Während es sich bei BNP um ein Neprilysinsubstrat handelt, ist dies bei NT-proBNP nicht der Fall.
BNP ist deshalb kein geeigneter Biomarker für Herzinsuffizienz bei mit Entresto behandelten Patienten (siehe «Warnhinweise und Vorsichtsmassnahmen»). NT-proBNP ist kein Neprilysin Substrat und ist daher besser als Biomarker geeignet.
In einer speziell dafür geplanten klinischen Studie mit gesunden männlichen Probanden zeigte die einmalige Verabreichung von 400 mg und 1200 mg Entresto keinerlei Wirkungen auf die kardiale Repolarisation.
Neprilysin ist eines von zahlreichen Enzymen, die an der Clearance von Amyloid-β (Aβ) aus dem Gehirn und der Zerebrospinalflüssigkeit (ZSF) beteiligt sind. Die Verabreichung von 400 mg Entresto einmal täglich über 2 Wochen an gesunde Probanden zeigte keine Veränderungen der Konzentration von Aβ 1-40 und Aβ 1-42 in der ZSF, ging allerdings mit einem Anstieg von Aβ 1-38 in der ZSF im Vergleich zu Placebo einher. Die klinische Bedeutung dieser Befunde ist nicht bekannt (siehe «Präklinische Daten»), da strukturelle und funktionelle Veränderungen im ZNS nicht untersucht wurden. Eine Studie an Patienten mit Herzinsuffizienz wird potenzielle Wirkungen von Entresto auf die kognitive Funktion und Amyloid-β-Ablagerung im Gehirn untersuchen.
Klinische Wirksamkeit
PARADIGM-HF
Bei PARADIGM-HF handelte es sich um eine multinationale, randomisierte Doppelblindstudie mit 8'442 Patienten, bei der Entresto mit Enalapril verglichen wurde. Die Arzneimittel wurden erwachsenen Patienten mit chronischer Herzinsuffizienz (NYHA-Klasse II – IV) und systolischer Dysfunktion (linksventrikuläre Auswurffraktion ≤40 %) zusätzlich zu anderen Therapien (>90% Betablocker, ca 80% Diuretika, ca. 50% Mineralokortikoidantagonisten) bei Herzinsuffizienz verabreicht. Der zusammengesetzte primäre Endpunkt bestand aus kardiovaskulär (KV) bedingtem Tod oder Hospitalisation aufgrund einer Herzinsuffizienz (HF).
Vor der Studienteilnahme waren die Patienten durch eine Therapie entsprechend dem Versorgungsstandard, u.a. mit ACE-Hemmern/ARB (> 99 %), Betablockern (94 %), Mineralokortikoidantagonisten (58 %) und Diuretika (83 %), gut eingestellt. Die mediane Beobachtungsdauer betrug 27 Monate, und die Patienten wurden über maximal 4,3 Jahre behandelt. Patienten mit einem systolischen BD <100mmHg wurden nicht in die Studie aufgenommen.
Die Patienten mussten ihre bestehende ACE-Hemmer- oder ARB-Therapie absetzen und wurden in eine sequenzielle, einfach verblindete Run-in-Phase eingeschlossen, während der sie mit Enalapril 10 mg zweimal täglich behandelt wurden. Die Anschlussbehandlung erfolgte mit einer Dosis von 100 mg Entresto zweimal täglich, die nach 1 bis 2 Wochen auf 200 mg zweimal täglich erhöht wurde. Patienten, die die Run-in-Behandlungen gut vertragen haben, wurden anschliessend randomisiert zu Entresto oder zu Enalapril. In der Doppelblindphase der Studie erhielten die Patienten 200 mg Entresto oder 10 mg Enalapril je zweimal täglich [Entresto (n=4.209); Enalapril (n=4.233)].
Das Durchschnittsalter des untersuchten Patientenkollektivs betrug 64 Jahre; 19 % waren 75 Jahre oder älter. Bei der Randomisierung wurden 70 % der Patienten in NYHA-Klasse II und 25 % in Klasse III/IV eingestuft.
In der Gruppe unter Entresto erhielten 76 % der Patienten bis zum Ende der Studie die angestrebte Dosis von 200 mg zweimal täglich (mittlere Tagesdosis 375 mg). In der Gruppe unter Enalapril erhielten 75 % der Patienten bis zum Ende der Studie die angestrebte Dosis von 10 mg zweimal täglich (mittlere Tagesdosis 18,9 mg).
Entresto senkte gegenüber Enalapril statistisch signifikant das Risiko für kardiovaskulären Tod bzw. eine stationäre Aufnahme aufgrund von Herzinsuffizienz um 20 % (Hazard Ratio [HR]: 0,80, 95-%-KI [0,73 - 0,87]. Die absolute Risikoreduktion betrug 4,69 %. Diese Wirkung wurde frühzeitig beobachtet und wurde über die Dauer der Studie aufrechterhalten. Es wurde ein statistisch signifikanter Rückgang der kardiovaskulär-bedingten Todesfälle und der ersten Herzinsuffizienz-bedingten stationären Aufnahme beobachtet (KV-bedingter Tod: RRR 20 %, HR 0,80; 95-%-KI [0,71 - 0,89],3.13% absolute Risikoreduktion; Herzinsuffizienz-bedingte stationäre Aufnahme: RRR 21 %; HR 0,79; 95-%-KI [0,71 - 0,89], absolute Risikoreduktion 2.80%); siehe Tabelle 3. Plötzlicher Herztod war die Ursache bei 45 % der KV-bedingten Todesfälle. Dieser Wert wurde bei Patienten unter Entresto im Vergleich zu Patienten unter Enalapril um 20 % gesenkt (HR 0,80;95% KI [0,68; 0,94]). Ein Ausfall der Pumpfunktion war die Ursache bei 26 % der KV-bedingten Todesfälle. Dieser Wert wurde bei Patienten unter Entresto im Vergleich zu Patienten unter Enalapril um 21 % gesenkt (HR 0,79; 95% KI [0,64; 0,98]).
Diese Risikoreduktion wurde in verschiedenen Untergruppen, u.a. bezüglich Alter, Geschlecht, ethnischer Zugehörigkeit, geografischer Herkunft, NYHA-Klasse, Auswurffraktion, Nierenfunktion, Diabetes oder Hypertonie in der Anamnese, frühere Behandlung bei Herzinsuffizienz und Vorhofflimmern, übereinstimmend beobachtet.
Darüber hinaus senkte Entresto im Vergleich zu Enalapril signifikant die Gesamtsterblichkeit um 16 % (RRR 16 %, HR 0,84; 95-%-KI [0,76 - 0,93]) (Tabelle 3). Die absolute Risikoreduktion betrug 2,84 %.
Tabelle 3 Behandlungswirkung auf den zusammengesetzten primären Endpunkt, seine Komponenten und die Gesamtsterblichkeit
|
|
Entresto
N = 4187#
n (%)
|
Enalapril
N = 4212#
n (%)
|
Hazard Ratio (95-%-KI)
|
Relative Risikoreduktion
|
Absolute Risikoreduktion
| |
Zusammengesetzter primärer Endpunkt bestehend aus KV-bedingtem Tod und stationärer Aufnahme aufgrund von Herzinsuffizienz*
|
914 (21,83)
|
1117 (26,52)
|
0,80 (0,73 - 0,87)
|
20 %
|
4,69%
| |
Einzelne Komponenten des zusammengesetzten primären Endpunkts
| |
KV-bedingter Tod **
|
558 (13,33)
|
693 (16,45)
|
0,80 (0,71 - 0,89)
|
20 %
|
3,13%
| |
Erste stationäre Aufnahme aufgrund von Herzinsuffizienz
|
537 (12,83)
|
658 (15,62)
|
0,79 (0,71 - 0,89)
|
21 %
|
2,80%
| |
Sekundärer Endpunkt
| |
Gesamtsterblichkeit
|
711 (16,98)
|
835 (19,82)
|
0,84 (0,76 - 0,93)
|
16 %
|
2,84%
|
*Der primäre Endpunkt war als Zeit bis zum ersten Ereignis definiert.
** KV-bedingte Todesfälle beinhalteten alle Patienten, die bis zum Stichtag unabhängig von einer früheren stationären Aufnahme verstarben.
# Vollständige Analysepopulation
Abbildung 0 Kaplan-Meier-Kurven für den zusammengesetzten primären Endpunkt und die Komponente «KV-bedingter Tod»
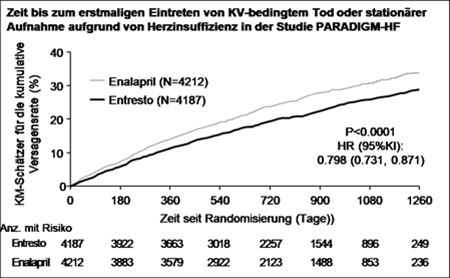
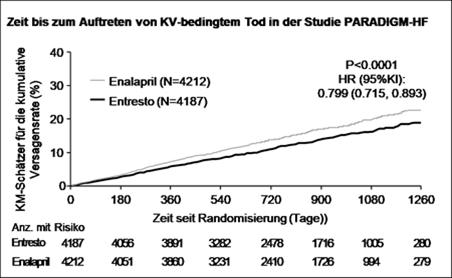
Eine geringere Anzahl von Patienten zeigte laut Beurteilung anhand des KCCQ-Fragebogens (Kansas City Cardiomyopathy Questionnaire) im Vergleich zu Enalapril eine Verschlechterung der HF-Symptome, einschliesslich Dyspnoe und Erschöpfung und körperlicher Einschränkungen.
PANORAMA-HF
PANORAMA-HF, eine Phase-3-Studie, war eine multinationale, randomisierte, doppelblinde Studie zum Vergleich von Sacubitril/Valsartan und Enalapril bei 375 pädiatrischen Patienten im Alter von 1 Monat bis < 18 Jahren mit Herzinsuffizienz aufgrund einer systemischen linksventrikulären systolischen Dysfunktion (links-ventrikuläre Auswurffraktion (Left Ventricular Ejection Fraction, LVEF) ≤45 % oder fraktioneller Verkürzung ≤22,5 %). Das primäre Ziel bestand darin, festzustellen, ob Sacubitril/Valsartan bei pädiatrischen Patienten mit Herzinsuffizienz über eine Behandlungsdauer von 52 Wochen auf der Grundlage eines globalen Endpunkts Enalapril überlegen war. Der primäre Endpunkt wurde durch eine Rangfolge der Patienten (schlechtestes bis bestes Ergebnis) auf der Grundlage von klinischen Ereignissen wie Tod, Einleitung mechanischer Lebenserhaltung, Einstufung für eine dringende Herztransplantation, Verschlechterung der Herzinsuffizienz, Messungen der funktionellen Kapazität (NYHA/ROSS-Scores) und von den Patienten berichtete HF-Symptome (auf der Patient Global Impression Scale [PGI-S]) abgeleitet. Patienten mit systemischen rechten Ventrikeln oder Einzelventrikeln und Patienten mit restriktiver oder hypertropher Kardiomyopathie wurden von der Studie ausgeschlossen. Die angestrebte Erhaltungsdosis von Sacubitril/Valsartan betrug 2,3 mg/kg Körpergewicht zweimal täglich bei pädiatrischen Patienten im Alter von 1 Monat bis < 1 Jahr und 3,1 mg/kg Körpergewicht zweimal täglich bei Patienten im Alter von 1 bis < 18 Jahren mit einer Höchstdosis von 200 mg zweimal täglich. Die angestrebte Erhaltungsdosis von Enalapril betrug 0,15 mg/kg Körpergewicht zweimal täglich bei pädiatrischen Patienten im Alter von 1 Monat bis < 1 Jahr und 0,2 mg/kg Körpergewicht zweimal täglich bei Patienten im Alter von 1 bis < 18 Jahren mit einer Höchstdosis von 10 mg zweimal täglich.
In der Studie waren 9 Patienten 1 Monat bis < 1 Jahr alt, 61 Patienten waren 1 Jahr bis < 2 Jahre alt, 85 Patienten waren 2 bis < 6 Jahre alt und 220 Patienten waren 6 bis < 18 Jahre alt. Zu Studienbeginn gehörten 15,7 % der Patienten zur NYHA/ROSS-Klasse I, 69,3 % zur Klasse II, 14,4 % zur Klasse III und 0,5 % zur Klasse IV. Die mittlere LVEF betrug 32 %. Die häufigste Ursache für die Herzinsuffizienz war eine Kardiomyopathie (63,5 %). Vor der Teilnahme an der Studie wurden die Patienten am häufigsten mit ACE-Hemmern/Angiotensin-Rezeptor-Blockern (ARB) (93 %), Betablockern (70 %), Aldosteron-Antagonisten (70 %) und Diuretika (84 %) behandelt.
Die Mann-Whitney-Odds für den primären globalen Endpunkt lagen bei 0,907 (p=0,424) und damit numerisch zugunsten von Sacubitril/Valsartan (siehe Tabelle 4). Sacubitril/Valsartan und Enalapril zeigten vergleichbare klinisch relevante Verbesserungen bei den sekundären Endpunkten NYHA/ROSS-Klasse und PGIS-Score-Veränderung im Vergleich zum Ausgangswert. In Woche 52 waren die Veränderungen der NYHA/ROSS-Funktionsklasse gegenüber dem Ausgangswert bei Sacubitril/Valsartan und Enalapril Folgende: verbessert bei 37,7 % bzw. 34,0 %, unverändert bei 50,6 % bzw. 56,6 % und verschlechtert bei 11,7 % bzw. 9,4 % der Patienten. In ähnlicher Weise verhielten sich die Veränderungen des PGIS-Scores gegenüber dem Ausgangswert: verbessert bei 35,5 % und 34,8 %; unverändert bei 48,0 % und 47,5 %; verschlechtert bei 16,5 % und 17,7 % der Patienten unter Sacubitril/Valsartan bzw. Enalapril. Das NT-proBNP wurde in beiden Behandlungsgruppen gegenüber dem Ausgangswert erheblich gesenkt. Das Ausmass der NT-proBNP-Reduktion war vergleichbar mit dem, das bei erwachsenen Patienten mit Herzinsuffizienz in PARADIGM-HF beobachtet wurde. Da Sacubitril/Valsartan in der PARADIGM-HF-Studie die Behandlungsergebnisse verbesserte und das NT-proBNP reduzierte, wurde der Rückgang des NT-proBNP in Verbindung mit den in der PANORAMA-HF-Studie beobachteten symptomatischen und funktionellen Verbesserungen gegenüber dem Ausgangswert als vernünftige Grundlage für die Ableitung eines klinischen Nutzens bei Patienten mit pädiatrischer Herzinsuffizienz angesehen. Die Ergebnisse waren in allen Altersgruppen konsistent. Es nahmen zu wenige Patienten im Alter von unter 1 Jahr an der Studie teil, um die Wirksamkeit von Sacubitril/Valsartan in dieser Altersgruppe beurteilen zu können.
Tabelle 4 Behandlungseffekt für den primären globalen Endpunkt in der Studie PANORAMA-HF
|
|
Sacubitril/Valsartan N=187
|
Enalapril N=188
|
Behandlungseffekt
| |
Globaler primärer Endpunkt
|
% der Wins*
|
% der Wins*
|
Odds** (95% CI)
| |
52,4
|
47,6
|
0.907 (0,72; 1,14) p-Wert 0,424
|
*Der Prozentsatz der Wins wurde auf der Grundlage von Vergleichen des globalen Rank Scores für jeden Patienten der mit Sacubitril und Valsartan und mit Enalapril behandelten Patienten berechnet (jede höhere Punktzahl zählt als ein Win und jede gleiche Punktzahl zählt als ein halber Win).
** Die Mann-Whitney-Odds wurden berechnet, indem der Prozentsatz der Wins für Enalapril durch den Prozentsatz der Wins für Sacubitril/Valsartan geteilt wurde, mit Odds (Quoten) <1 zugunsten von Sacubitril/Valsartan und >1 zugunsten von Enalapril.
|


