Eigenschaften/WirkungenATC-Code
M09AX07
Wirkungsmechanismus
Spinraza ist ein Antisense-Oligonukleotid (ASO), das speziell für die Behandlung von SMA, einer autosomal-rezessiven progressiven neuromuskulären Krankheit infolge von Mutationen des SMN1-Gens (Survival Motor Neuron 1) auf Chromosom 5q, entwickelt worden ist. Diese Mutationen führen zum Verlust der Funktion des SMN1-Gens und dadurch zu einem Mangel an SMN-Protein. SMN-Protein wird auch vom SMN2-Gen hergestellt, jedoch in viel geringerer Menge. SMA ist der Sammelbegriff für ein klinisches Spektrum von Krankheiten.
Das Alter, in dem sich die Krankheit erstmals äusserst, und die Schwere der Krankheit hängen mit der Anzahl der vorhandenen Kopien des SMN2-Gens zusammen; weniger SMN2-Genkopien sind mit einem altersbezogen früheren Beginn der Krankheit und mit stärkeren Symptomen verbunden.
Spinraza erhöht den Exon-7-Anteil von SMN2 in der transkribierten Messenger-Ribonukleinsäure (mRNA), indem es an eine intronische Splice-Silencing-Stelle (ISS-N1) im Intron 7 der prä-mRNA von SMN2 bindet. Durch diese Hybridisierung verdrängt das ASO Splicing-Faktoren, die das Splicing normalerweise unterdrücken. Die Verdrängung dieser Faktoren führt dazu, dass Exon 7 in der SMN2-mRNA erhalten bleibt. Nachdem die SMN2-mRNA gebildet worden ist, kann sie zu dem funktionsfähigen SMN-Protein in Volllänge translatiert werden.
Pharmakodynamik
Die pharmakodynamischen Wirkungen korrelieren mit den biologischen Wirkungen von Nusinersen.
Autopsie-Proben von behandelten Kleinkindern wiesen höhere Mengen an SMN2-mRNA mit Exon 7 im thorakalen Rückenmark auf als Proben von unbehandelten Kleinkindern mit SMA.
Klinische Wirksamkeit
Ergebnisse zur Wirksamkeit
Die Wirksamkeit von Spinraza wurde in 7 klinischen Studien bei symptomatischen Patienten (Studien CS3B, CS3A, CS4, CS2, CS12, CS7 und CS11) gezeigt, die zum Zeitpunkt der ersten Dosis 30 Tage bis 15 Jahre alt waren sowie in einer klinischen Studie bei präsymptomatischen Patienten (Studie CS5), die zum Zeitpunkt der ersten Dosis 3 bis 42 Tage alt waren. Die Wirksamkeits-Resultate dieser Studien mit bis zu 1429 Behandlungstagen unterstützen einen Therapiebeginn so schnell wie möglich nach der Diagnose.
Symptomatische Patienten
Infantile Form
Studie CS3B (ENDEAR)
Studie CS3B war eine Phase-3, randomisierte, doppel-blinde Studie mit Sham-Verfahrenskontrolle, die bei 121 symptomatischen Kleinkindern im Alter von ≤7 Monaten mit diagnostizierter SMA (Symptombeginn vor dem Alter von 6 Monaten) durchgeführt wurde. Die Patienten wurden 2:1 randomisiert und erhielten entweder Spinraza (gemäss dem genehmigten Dosierungsschema) oder die Sham-Kontrolle. Die Behandlungsdauer betrug 6 bis 442 Tage (Medianwert: 258 Tage).
Das mediane Alter beim ersten Auftreten klinischer Anzeichen und Symptome der SMA war 6,5 Wochen (Spanne von 2 - 18 Wochen) bei den Spinraza behandelten Patienten bzw. 8 Wochen (Spanne von 1 - 20 Wochen) bei den Patienten der Sham-Gruppe, wobei 99 % der Patienten 2 Kopien des SMN2-Gens besassen und daher am wahrscheinlichsten von der Entwicklung einer Typ-I-SMA betroffen waren.
Bei der Baseline war der mittlere Gesamtwert der motorischen Meilensteine 1,37 (von 0 - 6), das mediane CHOP INTEND Ergebnis war 28 (von 8 - 50,5) und die mediane CMAP Amplitude war 0,20 (von 0,00 - 0,87) für den Nervus ulnaris und 0,30 (von 0,00 - 1,50) für den Nervus peroneus. Das mediane Alter bei Verabreichung der ersten Dosis betrug bei den Patienten in der Behandlungsgruppe 164,5 Tage (Spanne von 52 - 242 Tagen) und bei den Patienten in der Sham-kontrollierten Gruppe 205 Tage (Spanne von 30 - 262 Tagen).
Bei der Baseline waren die Charakteristika weitgehend dieselben bei den Spinraza behandelten Patienten wie bei der Sham-Kontroll-Gruppe ausser den folgenden Ereignissen, die bei den Spinraza behandelten Patienten häufiger als bei der Sham-Kontrolle auftraten: Paradoxe Atmung (89 % versus 66 %), Pneumonie oder respiratorische Symptome (35 % versus 22 %), Schluck- oder Essbeschwerden (51 % versus 29 %) und der Bedarf respiratorischer Unterstützung (26 % versus 15 %).
Es wurde eine geplante Zwischenanalyse durchgeführt, basierend auf Patienten, welche verstarben, abbrachen, oder eine Behandlung von mindestens 183 Tagen abschlossen. Zum Zeitpunkt der Zwischenanalyse der Studie erhielten 121 Patienten die Behandlung (Spinraza n = 80, Sham-Kontrolle n = 41). Zum Zeitpunkt der Zwischenanalyse erreichten insgesamt 78 Patienten die Behandlungsdauer von mindestens 183 Tagen, verstarben oder brachen die Studie ab und wurden in dem Interim Efficacy Set für die Analyse des primären Endpunktes (Spinraza n = 51, Sham-Kontrolle n = 27) eingeschlossen. Der primäre Endpunkt zum Zeitpunkt der Zwischenanalyse war der Anteil der Responder: Patienten, die einen vordefinierten Bereich der Verbesserung der motorischen Meilensteine gemäss Abschnitt 2 des Hammersmith Infant Neurologic Examination (HINE) erreichten. Ein Behandlungs-Responder war definiert als ein Patient, der eine Erhöhung des Ergebnisses um mindestens 2 Punkte (oder ein maximales Ergebnis von 4) in Bezug auf die Fähigkeit zu Strampeln erreichte oder mindestens eine Erhöhung des Ergebnisses um 1 Punkt in Bezug auf die motorischen Meilensteine Kopfkontrolle, Rollen, Sitzen, Krabbeln, Stehen oder Gehen erreichte. Um als Responder definiert zu werden, mussten sich die Patienten in mehr Kategorien der motorischen Meilensteine verbessern als verschlechtern. Patienten, welche verstarben oder die Studie abbrachen, wurden in dem Interim Efficacy Set eingeschlossen und als Nicht-Responder betrachtet. Von den 78 Patienten, die sich für die Zwischenanalyse qualifizierten, wurde ein statistisch signifikant höherer Prozentsatz als motorische Meilensteine Responder in der Spinraza Gruppe (41 %) als in der Sham-Kontroll-Gruppe (0 %) definiert, bei einem Unterschied (95 % CI) in prozentualen Anteilen von 41,18 % (18,16; 61,20) (Nusinersen – Sham-Kontrolle), p < 0,0001.
Nach der positiven Zwischenanalyse wurde die Studie CS3B gestoppt und die Patienten in einer Open-Label Verlängerungsstudie (CS11) eingeschlossen.
Zum Zeitpunkt der Abschlussanalyse wurde die Zeit bis zum Tod oder bis zur permanenten Beatmung (≥16 Stunden Beatmung pro Tag ununterbrochen während 21 Tagen ohne ein akutes reversibles Ereignis oder eine Tracheostomie) als primärer Endpunkt ausgewertet. Statistisch signifikante Effekte auf Ereignis-freies Überleben, Gesamt-Überleben, den Anteil der Patienten, die die Definition eines motorischen Meilenstein-Responders erreichten und den Prozentsatz der Patienten mit mindestens 4 Punkten Verbesserung von der Baseline im CHOP INTEND Ergebnis wurden in der Spinraza-Gruppe versus Sham-Kontrolle beobachtet (Tabelle 5). Eine statistisch signifikante 47%ige Reduktion des Sterberisikos oder einer permanenten Beatmung wurde in der ITT Population (p = 0,0046) beobachtet. Eine mediane Zeit bis zum Tod oder bis zur permanenten Beatmung wurde in der Spinraza Gruppe nicht erreicht, während sie in der Sham-Kontroll-Gruppe 22,6 Wochen betrug. Eine statistisch signifikante 62,8%ige Reduktion des Sterberisikos wurde ebenfalls beobachtet (p = 0,0041).
Im Wirksamkeits-Set benötigten 18 (25 %) Patienten der Spinraza-Gruppe und 12 (32 %) Patienten der Sham-Kontrollgruppe eine permanente Beatmung. Während keiner dieser Patienten der Studie CS3B die permanente Beatmung unterbrach, entsprachen 6 (33 %) Patienten der Spinraza-Gruppe und 0 (0 %) Patienten der Sham-Kontrollgruppe der im Protokoll definierten Kriterien eines motorischen Meilenstein Responders.
11 (61 %) Patienten der Spinraza-Gruppe und 3 (25 %) Patienten der Sham-Kontrollgruppe erreichten mindestens 1 Punkt Verbesserung des Gesamtergebnisses der motorischen Meilensteine. 0 (0 %) Patienten der Spinraza-Gruppe und 3 (25 %) Patienten der Sham-Kontrollgruppe erfuhren mindestens 1 Punkt Verschlechterung im Gesamtergebnis der motorischen Meilensteine.
Ein statistisch signifikant grösserer Prozentsatz (p < 0,0001) der Teilnehmer des Wirksamkeits-Sets, die mit Spinraza behandelt wurden (71 %), erreichte eine Verbesserung von mindestens 4 Punkten von der Baseline im CHOP INTEND Ergebnis gegenüber der Sham-Kontrolle (3 %). Ebenso erfuhren 3 % der Spinraza-Gruppe und 46 % der Sham-Kontroll-Gruppe eine Verschlechterung des CHOP INTEND Ergebnis gegenüber der Baseline.
Tabelle 5: Primäre und sekundäre Endpunkte bei der Abschlussanalyse – Studie CS3B
|
Wirksamkeits-Parameter
|
Mit Spinraza behandelte Patienten
|
Patienten mit Sham-Kontrolle
| |
Überleben
| |
Ereignisfreies Überleben2
| |
Anzahl Patienten, die verstarben oder permanent beatmet werden mussten
|
31 (39 %)
|
28 (68 %)
| |
Hazard Ratio (95 % KI)
|
0,53 (0,32 - 0,89)
| |
p-Wert6
|
p = 0,0046
| |
Anzahl Patienten, die eine permanente Beatmung benötigten2
|
18 (23 %)
|
13 (32 %)
| |
Hazard Ratio (95 % KI)
|
0,66 (0,322 – 1,368)
| |
p-Wert6
|
p = 0,1329
| |
Gesamtüberleben2
| |
Anzahl Patienten, die gestorben sind
|
13 (16 %)
|
16 (39 %)
| |
Hazard Ratio (95 % KI)
|
0,37 (0,18 – 0,77)
| |
p-Wert6
|
p = 0,0041
| |
Motorische Funktion
| |
Motorische Meilensteine3
| |
Anteil der Patienten, welche die vorab festgelegten Kriterien für Responder mit motorischen Meilensteinen erreichten (HINE Abschnitt 2)4,5
|
37 (51 %)1
p < 0,0001
|
0 (0 %)
| |
Anteil an Tag 183
|
30/73 (41 %)
|
2/37 (5 %)
| |
Anteil an Tag 302
|
22/49 (45 %)
|
0/28 (0 %)
| |
Anteil an Tag 394
|
20/37 (54 %)
|
0/21 (0 %)
| |
Anteil mit Verbesserung der Gesamtpunktzahl der motorischen Meilensteine
|
49 (67 %)
|
5 (14 %)
| |
Anteil mit Verschlechterung der Gesamtpunktzahl der motorischen Meilensteine
|
1 (1 %)
|
8 (22 %)
| |
CHOP-INTEND3
| |
Anteil mit Verbesserung um 4-Punkte
|
52 (71 %)
p < 0,0001
|
1 (3 %)
| |
Anteil mit Verschlechterung um 4-Punkte
|
2 (3 %)
|
17 (46 %)
| |
Anteil mit jeglicher Verbesserung
|
53 (73 %)
|
1 (3 %)
| |
Anteil mit jeglicher Verschlechterung
|
5 (7 %)
|
18 (49 %)
|
1CS3B wurde nach einer positiven statistischen Analyse des primären Endpunktes bei der Interim-Analyse beendet (ein statistisch signifikant grösserer Prozentsatz von Patienten in der Spinraza-Gruppe (41 %) erfüllte die Definition eines Responders mit motorischem Meilenstein als in der Kontrollgruppe mit Scheinintervention (0 %) (p < 0,0001)).
2Zum Zeitpunkt der Abschlussanalyse wurden das ereignisfreie Überleben und das Gesamtüberleben anhand des Intent-to-Treat-Kollektivs ausgewertet (ITT: Spinraza n = 80, Kontrolle mit Scheinintervention n = 41).
3Zum Zeitpunkt der Abschlussanalyse wurden Analysen von CHOP INTEND und der motorischen Meilensteine anhand des Wirksamkeitskollektivs vorgenommen (Spinraza n = 73, Kontrolle mit Scheinintervention n = 37).
4Bewertung bei Studienvisite am Tag 183, Tag 302 oder Tag 394 der Studie, je nachdem was der jeweils späteste Erhebungszeitpunkt war.
5Nach der Hammersmith Infant Neurological Examination (HINE) Abschnitt 2: Verbesserung um ≥2 Punkte [oder Höchstpunktzahl] für die Fähigkeit zu strampeln ODER Verbesserung der motorischen Meilensteine Kopfkontrolle, Rollen, Sitzen, Krabbeln, Stehen oder Gehen um ≥1 Punkt UND Verbesserungen in mehr Kategorien von motorischen Meilensteinen als Verschlechterungen, definiert als Responder in dieser primären Analyse.
6 Basierend auf einem Log Rank Test, welcher stratifiziert wurde mit der Krankheitsdauer.
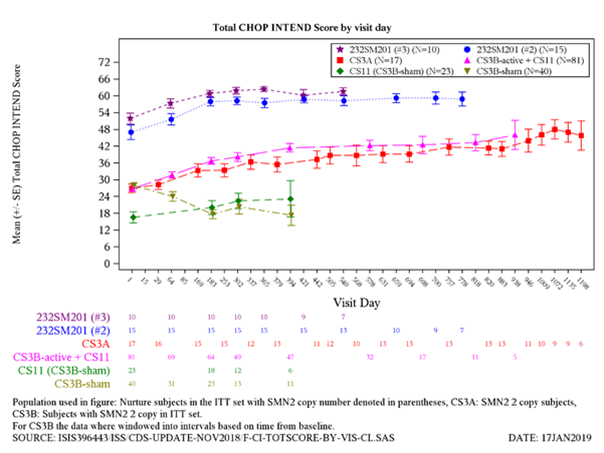
Nach Abschluss der Studie CS3B wurden 89 Patienten (65 mit Spinraza behandelt und 24 mit Sham-Kontrolle) in die laufende offene Verlängerungsstudie (Studie CS11) eingeschlossen, bei der zum Zeitpunkt der Zwischenanalyse alle Patienten Spinraza für 65 bis 592 Tage (im Median 289 Tage) erhielten (Stichtag 30. Juni 2018). Sowohl bei Patienten, die die Behandlung mit Spinraza in der Studie CS11 fortsetzten, als auch bei Patienten, die die Behandlung mit Spinraza in der Studie CS11 begannen, wurden Verbesserungen der motorischen Funktion (Abbildung 2 und 3) beobachtet, wobei der grösste Nutzen bei Patienten mit einem früheren Behandlungsbeginn assoziiert war. Bei den Patienten, die zu Beginn der Studie CS11 nicht permanent beatmet wurden, war die Mehrheit in der Zwischenanalyse am Leben und ohne permanente Beatmung.
Bei Patienten der Studie CS11, die davor in der Studie CS3B die Spinraza Behandlung erhielten, betrug die mittlere Zeit bis zum Tod oder bis zu einer permanenten Beatmung 73 Wochen. Zum Zeitpunkt der Interim-Analyse der Studie CS11 lebten 61 der 65 (94 %) Patienten. Von den 45 der 65 Patienten, die den Wirksamkeitsendpunkt permanente Beatmung in der Studie CS3B nicht erreichten, lebten in der Studie CS11 bei der Zwischenanalyse 38 der 45 (84 %) Patienten ohne permanente Beatmung. In der Studie CS11 wurden vom Studienbeginn bis zum Studientag 304 weitere Verbesserungen der durchschnittlichen Gesamtpunktzahlen für motorische Meilensteine (2,1; SD 4,36; n = 22) und des CHOP INTEND Scores (4,68; SD 3,993; n = 22) beobachtet.
Die 24 Patienten, die erst in Studie CS11 eine Behandlung mit Spinraza begonnen hatten (n = 24; mit Sham-Kontrolle in Studie CS3B), hatten zu Studienbeginn in Studie CS11 ein Durchschnittsalter von 17,8 Monaten (10 - 23 Monate) und einen mittleren CHOP INTEND-Score von 17,25 (2,0 - 46,0). Zum Zeitpunkt der Zwischenanalyse lebten 22 dieser 24 Patienten (92 %). Von 12 dieser 24 Patienten (50 %), die in der Studie CS3B den Wirksamkeitsendpunkt permanente Beatmung nicht erreicht hatten, lebten zum Zeitpunkt der Zwischenanalyse der Studie CS11 7 von 12 Patienten (58 %) ohne permanente Beatmung. Die mediane Zeit bis zum Tod oder zur permanenten Beatmung betrug nach Behandlungsbeginn mit Spinraza in Studie CS11 50,9 Wochen. Vom Studienbeginn bis zum Studientag 304 wurden in Studie CS11 Verbesserungen der durchschnittlichen Gesamtpunktzahlen für motorische Meilensteine (1,2; SD 1,8; n = 12) und des CHOP INTEND Scores (3,58; SD 7,051; n = 12) beobachtet.
Studie CS3A
Studie CS3A war eine offene Phase-2-Studie in symptomatischen Patienten mit SMA-Diagnose. Das mediane Lebensalter bei Beginn der klinischen Anzeichen und Symptome betrug 56 Tage (21 - 254 Tage) und die Patienten wiesen entweder 2 Kopien des SMN2-Gens (n = 17) oder 3 Kopien dieses Gens (n = 2) auf (zu einem Patienten liegen keine Angaben über die Anzahl der SMN2-Gen-Kopien vor). Bei den Patienten in dieser Studie wurde die Möglichkeit, dass sie eine SMA Typ I entwickeln, als sehr wahrscheinlich eingestuft. Das mediane Lebensalter bei der ersten Dosis betrug 162 Tage (37 - 223 Tage). Die Patienten waren für eine mediane Dauer von 1101 Tagen (62 - 1429 Tage) in der Studie.
Der primäre Endpunkt war der Anteil an Patienten mit Verbesserungen in einer oder mehreren Kategorien von motorischen Meilensteinen (gemäss HINE Abschnitt 2: Verbesserung um ≥2 Punkte [oder Höchstpunktzahl] für die Fähigkeit zu strampeln oder spontanes Greifen oder Verbesserung der motorischen Meilensteine Kopfkontrolle, Rollen, Sitzen, Krabbeln, Stehen oder Gehen um ≥1 Punkt). 12 von 20 Patienten (60 %) erreichten den primären Endpunkt mit einer anhaltenden Verbesserung beim Mittelwert der im Zeitverlauf erzielten motorischen Meilensteine (Abbildung 2 und 3).
Eine anhaltende Verbesserung der mittleren CHOP-INTEND-Punktzahl wurde vom Ausgangswert bis Tag 1072 beobachtet (mittlere Veränderung 21,30). Insgesamt erreichten 11 von 20 Patienten (55 %) den Endpunkt einer Verbesserung der CHOP-INTEND Gesamtpunktzahl um ≥4 Punkte bis zur letzten Studienvisite für die Studie vor dem Stichtag für die Einstellung der Datenerhebung.
Bei der letzten Visite waren von den 20 eingeschlossenen Studienteilnehmern 11 Patienten (55 %) am Leben und benötigten keine permanente Beatmung. Vier Patienten erfüllten die Kriterien der permanenten Beatmung und fünf Patienten verstarben während der Studie.
Späterer Krankheitsbeginn
Studie CS4 (CHERISH)
Studie CS4 ist eine Phase 3, randomisierte, doppel-blinde, Sham-kontrollierte Studie bei 126 symptomatischen Kindern mit late onset SMA (symptomatischer Start nach einem Alter von 6 Monaten). Die Patienten wurden 2:1 zu Spinraza (mit 3 Aufsättigungsdosen sowie Erhaltungsdosen alle 6 Monate) und Sham-Kontrolle randomisiert, mit einer Therapiedauer von 324 bis 482 Tagen (Median 450 Tage). Nach der positiven Zwischenanalyse wurde die Studie CS4 gestoppt und die Patienten in die Open-Label Extensionsstudie (CS11) miteingeschlossen.
Das mediane Alter zum Zeitpunkt des Screenings war 3 Jahre (im Bereich von 2 – 9 Jahren) und das mediane Alter zum Zeitpunkt des Ausbruchs der klinischen Zeichen und Symptome von SMA war 11 Monate (im Bereich von 6 - 20 Monaten). Die Mehrheit der Patienten (88 %) hatte 3 Kopien des SMN2-Gens (8 % haben 2 Kopien, 2 % haben 4 Kopien und 2 % haben eine unbekannte Anzahl an Kopien). Bei der Baseline erreichten die Patienten einen durchschnittlichen HFMSE Score von 21,6 und einen durchschnittlichen RULM von 19,1. Alle Patienten erreichten unabhängig zu sitzen, jedoch erreichte keiner der Patienten unabhängig zu laufen. Die Patienten in dieser Studie wurden als Patienten erachtet, die höchstwahrscheinlich Typ II oder Typ III SMA entwickeln.
Die Baseline Krankheits-Charakteristika waren generell gleich mit der Ausnahme eines Ungleichgewichts beim Anteil der Patienten, die jemals die Fähigkeit erreichten, ohne Hilfe zu stehen (13 % der Spinraza-Gruppe gegenüber 29 % der Sham-Kontrolle) oder mit Hilfe zu gehen (24 % der Spinraza-Patienten gegenüber 33 % der Sham-Kontrolle).
Eine Interim-Analyse erfolgte als bei allen Patienten die Bewertung in Monat 6 abgeschlossen wurde und mindestens 39 Patienten die Bewertung in Monat 15 abgeschlossen hatten. Der zum Zeitpunkt der Interim–Analyse bestimmte primäre Endpunkt war die Veränderung der Punktzahl des HFMSE in Monat 15 gegenüber der Baseline. Die primäre Analyse wurde mit dem ITT-Kollektiv durchgeführt, welches alle einschliesst, die randomisiert und mindestens 1 Dosis Spinraza oder 1 Sham-Kontrolle erhalten hatten (Spinraza n = 84; Sham-Kontrolle n = 42). Post-Baseline HFMSE Daten für Patienten ohne Besuch in Monat 15 wurden mittels Multiple Imputation Method berechnet. Eine statistisch signifikante Verbesserung des Ergebnisses von Baseline HFMSE wurde bei Spinraza-behandelten Patienten im Vergleich zu Sham-kontrollierten Patienten beobachtet (Tabelle 6).
Die Resultate der Abschluss-Analyse stimmen mit den Resultaten der Interim-Analyse überein und zeigen in der Spinraza-Gruppe eine statistisch signifikante Verbesserung der HFMSE-Punktzahl im Monat 15 gegenüber Baseline im Vergleich zur Sham-Kontroll-Gruppe (Tabelle 6, Abbildung 1).
Eine Analyse einer Patienten-Subgruppe aus der ITT-Population, von der Werte vom Monat 15 dokumentiert wurden, zeigte konstante, statistisch signifikante Resultate (p = 0,0000002). Die statistische Analyse wurde mittels eines ANCOVA Modells sowie einer Regression mit Anpassung für das Alter beim Screening und des Baseline HFMSE Score durchgeführt. Von den Patienten mit beobachteten Werten im Monat 15 hatte ein höherer Anteil der Spinraza behandelten Patienten eine Verbesserung (73 % vs 41 %) und ein kleinerer Anteil eine Verschlechterung (23 % vs 44 %) der totalen HFMSE-Punktzahl gegenüber der Sham-Kontroll-Gruppe.
Bei der Abschluss-Analyse wurden alle sekundären Endpunkte inklusive funktionale Messwerte und die WHO motorischen Meilenstein-Werte formal statistisch getestet und sind in Tabelle 6 dargestellt.
Ein Therapie-Beginn so früh wie möglich nach der Diagnose zeigte eine frühere und grössere Verbesserung der motorischen Funktion als bei späterem Behandlungs-Beginn. Jedoch zeigte sich bei beiden Gruppen ein Nutzen gegenüber der Sham-Kontrolle.
Abbildung 1: Durchschnittliche Änderung von der Baseline des HFMSE-Ergebnisses mit der Zeit (ITT1) – Studie CS41,2
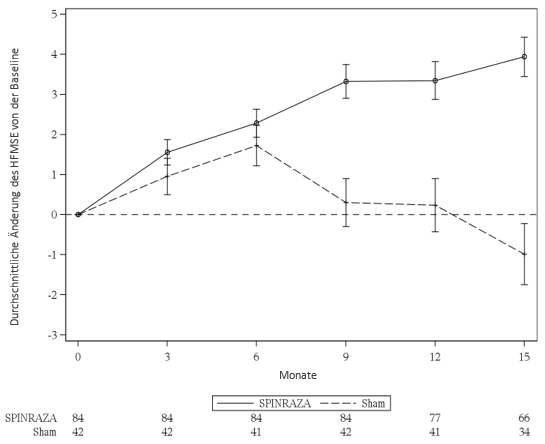
1Anzahl Patienten mit einem beobachteten Wert zu jedem auf der x-Achse aufgeführten Zeitpunkt. Die aufgeführten Durchschnittswerte wurden für das ITT Set (Spinraza n = 84, Sham-Kontrolle: n = 42) mittels Multiple Imputation Method berechnet.
2Die Fehlerbalken zeigen die +/- Standardabweichungen
Tabelle 6: Primäre und sekundäre Endpunkte bei der Abschluss-Analyse – Studie CS41
|
|
Spinraza-behandelte Patienten
|
Sham-kontrollierte Patienten
| |
HFMSE Punktzahl
| |
Veränderung der HFMSE-Gesamtpunktzahl gegenüber dem Ausgangswert nach 15 Monaten1,2,3
|
3,9
(95 % CI: 3,0; 4,9)
p = 0,0000001
|
-1,0
(95 % CI: -2,5; 0,5)
| |
Anteil der Patienten, die eine Verbesserung um mindestens 3 Punkte gegenüber dem Ausgangswert erreichten1,4
|
56,8 %
(95 % CI: 45,6; 68,1)
p = 0,00065, 6
|
26,3 %
(95 % CI: 12,4; 40,2)
| |
RULM
| |
Mittlere Veränderung gegenüber dem Ausgangswert bis Monat 15 bei der RULM-Gesamtpunktzahl1,2,3
|
4,2
(95 % CI: 3,4; 5,0)
p = 0,00000016
|
0,5
(95 % CI: -0,6; 1,6)
| |
WHO motorische Meilensteine
| |
Anteil der Patienten, die bis Monat 15 einen beliebigen neuen motorischen Meilenstein erreichten,4
|
19.7 %
(95 % CI: 10,9; 31,3)
p = 0,0811
|
5.9 %
(95 % CI: 0,7; 19,7)
| |
Durchschnittliche erreichte Zahl neuer motorischer Meilensteine2,3,4
|
0,2 (range -1 to 2,
95 % CI: 0,1; 0,3)
p = 0,00016
|
-0,2 (range -1 to 1,
95 % CI: -0,4; 0,0)3
|
1Bestimmt anhand der Intent to Treat Population (Spinraza, n = 84; Shamcontrol, n = 42); die Daten von Patienten ohne Studienvisite in Monat 15 wurden nach dem Verfahren der multiplen Imputation berechnet.
2Mittelwert der kleinsten Quadrate des ANCOVA Modells, wobei die Behandlung als Effekt fixiert wurde und eine Anpassung bei jedem Patienten für das Alter beim Screening und den Baseline Score vorgenommen wurde.
3 Negative Werte zeigen eine Verschlechterung, positive Werte eine Verbesserung.
4 Bestimmt anhand des Monat 15 Wirksamkeits-Sets (Spinraza n = 66; Sham-Kontrolle n = 34; Analyse basiert auf kalkulierten Werten, wenn die Daten fehlen).
5 Basiert auf logistischer Regression mit Behandlungseffekt und Anpassung um das Alter jedes Patienten beim Screening und den HFMSE-Score bei Baseline
6 Nominaler p-Wert.
Hinweis: Anzahl Patienten in der ITT, welche jeden Besuch wahrgenommen haben: Monate 3, 6, 9 (Spinraza n = 84, Sham-Kontrolle n = 42), Monat 12 (Spinraza n = 77, Sham-Kontrolle n = 41), Monat 15 (Spinraza n = 66, Sham-Kontrolle n = 34).
Nach Abschluss der Studie CS4 wurden 125 Patienten in die laufende offene Extensionsstudie (Studie CS11) eingeschlossen. Zum Zeitpunkt der Zwischenanalyse erhielten die Patienten für 74 bis 474 Tage (Median 250 Tage) Spinraza. Die Mehrheit der mit Spinraza behandelten Patienten erfuhr eine Stabilisierung oder Verbesserung der motorischen Funktionen, wobei der grösste Nutzen bei denjenigen beobachtet wurde, die die Behandlung mit Spinraza in der Studie CS4 begonnen hatten.
Bei den Patienten, die die Behandlung mit Spinraza in der Studie CS4 (n = 39) begannen, wurden von Studienbeginn bis zum Studientag 265 der Studie CS11 Stabilisierungen oder zusätzliche Verbesserungen der mittleren HFMSE-Werte (0,2; SD 3,6) und der RULM-Werte (0,7; SD 2,69) beobachtet.
Patienten, die die Behandlung mit Spinraza in der Studie CS11 (n = 20) begannen, hatten ein Durchschnittsalter von 4,0 Jahren (3 - 8 Jahre). Bei diesen Patienten wurden bis zum Studientag 265 in Studie CS11 Stabilisierungen oder Verbesserungen der mittleren HFMSE- (1,4; SD 4,02) und RULM-Werte (2,1; SD 2,56) beobachtet.
Studien CS2 und CS12
Diese Ergebnisse werden durch 2 offene Studien (Studie CS2 und Studie CS12) unterstützt. Die Analyse schloss 28 Patienten ein, die ihre erste Dosis in Studie CS2 erhielten und dann in die Verlängerungsphase, Studie CS12, übernommen wurden. In die Studien wurden Patienten eingeschlossen, die bei der ersten Dosis zwischen 2 und 15 Jahre alt waren. Von den 28 Patienten waren 3 bei ihrer letzten Studienvisite im Rahmen der Studie mindestens 18 Jahre alt. Von den 28 Patienten hatte einer 2 Kopien des SMN2-Gens, 21 hatten 3 Kopien und 6 hatten 4 Kopien. Die Patienten in dieser Studie wurden mit Typ II oder Typ III SMA diagnostiziert. Der durchschnittliche HFMSE Baseline Wert bei den Patienten mit Typ II SMA (n = 11) war 21,3 (im Bereich von 6 - 35) und bei Patienten mit Typ III SMA (n = 17) 48,9 (im Bereich von 20 - 63).
Der durchschnittliche Baseline Wert des Upper Limb Module (ULM) Tests bei Patienten mit Typ II SMA war 11,9 (im Bereich von 7 - 17) und der durchschnittliche 6-Minuten-Gehtest (6MWT, six-minute walk test) bei Baseline bei den Typ III ambulanten Patienten (n = 13) war 253,3 Meter (Bereich von 0 - 563 Meter).
Die Patienten wurden über einen Behandlungszeitraum von 3 Jahren beurteilt. Eine anhaltende Verbesserung wurde bei Patienten mit Typ II SMA beobachtet, wobei die mittlere Verbesserung der HFMSE-Punktzahl gegenüber dem Ausgangswert nach 253 Tagen bei 5,1 (SD 4,05; n = 11) und nach 1050 Tagen bei 9,1 (SD 6,61; n = 9) lag. Die mittlere Punktzahl nach 253 Tagen war 26,4 (SD 11,91) und nach 1050 Tagen 31,1 (SD 13,02), wobei kein Plateau beobachtet wurde. Dies steht im Vergleich zu der Abnahme der Punktzahl, die normalerweise bei Patienten mit later-onset SMA mit der Zeit beobachtet wird.
Patienten mit Typ III SMA zeigten eine mittlere Verbesserung der HFMSE-Punktzahl gegenüber der Baseline von 1,3 Punkten (SD 1,87; n = 16) nach 253 Tagen und von 1,2 (SD 4,64; n = 11) nach 1050 Tagen.
Bei Patienten mit Typ II SMA war die durchschnittliche Verbesserung von der Baseline des Upper Limb Module 1,9 (SD 2,68; n = 11) nach 253 Tagen und 3.5 (SD 3,32; n = 9) nach 1050 Tagen. Die mittlere Gesamtpunktzahl war 13,8 (SD 3,09) nach 253 Tagen und 15,7 (SD 1,92) nach 1050 Tagen.
Der 6-Minuten-Gehtest (6MWT, six-minute-walk test) wurde nur bei gehfähigen Patienten durchgeführt. Bei diesen Patienten wurde nach 253 Tagen eine Verbesserung von 47,22 Meter (SD 27,5; n = 12) und nach 1050 Tagen von 86,5 Meter (SD 40,58; n = 8) beobachtet. Die mittlere 6MWT-Gehstrecke betrug 278,2 Meter (SD 206,46) nach 253 Tagen und 333,6 Meter (SD 176,47) nach 1050 Tagen. Zwei Patienten, die zuvor nicht ohne Hilfe gehfähig waren (SMA Typ III) sowie ein nicht gehfähiger Patient (SMA Typ II) erlangten die Fähigkeit, unabhängig zu gehen.
Patienten mit infantiler Form der SMA oder späterem Krankheitsbeginn
Studie CS7 (EMBRACE)
Studie CS7 ist eine zweiteilige Phase 2 Studie, bei der Teil 1 als randomisierte, doppelblinde und Sham kontrollierte und Teil 2 als Open-Label-Erweiterung durchgeführt wurde. In die Studie wurden symptomatische Patienten mit einer infantilen Form der SMA bei Säuglingen (≤6 Monate) oder später auftretender SMA (> 6 Monate) mit 2 oder 3 Kopien von SMN2, die aufgrund des Screening-Alters, des Screening-Verfahrens oder der SMN2-Kopienzahl nicht für eine Teilnahme an den Studien CS3B oder CS4 geeignet waren, eingeschlossen. Die Patienten wurden im Teil 1 der Studie über einen medianen Zeitraum von 302 Tagen beobachtet.
Alle mit Spinraza behandelten Patienten waren am Ende von Teil 1 der Studie am Leben, jedoch starb ein Patient im Kontrollarm am Studientag 289. Darüber hinaus benötigte kein Patient der Spinraza- oder Sham-Kontroll-Gruppe eine permanente Beatmung. Von den 13 Patienten mit infantiler SMA erreichten 7/9 (78 %; 95 % CI: 45, 94) der Spinraza-Gruppe und 0/4 (0 %; 95 % CI: 0, 60) mit Sham-Kontrolle den Wirksamkeitsendpunkt motorische Meilensteinentwicklung (HINE-Abschnitt 2). Von den 8 Patienten mit SMA mit späterem Krankheitsbeginn haben 4/5 (80 %; 95 % CI: 38, 96) der Spinraza-Gruppe und 2/3 (67 %; 95 % CI: 21, 94) mit Sham-Kontrolle diesen Endpunkt erreicht.
Präsymptomatische Säuglinge
Studie CS5 (NURTURE)
Studie CS5 ist eine unverblindete Studie bei präsymptomatischen Kleinkindern mit genetischer SMA-Diagnose, die im Alter von 6 Wochen oder davor in die Studie aufgenommen wurden.
Die Patienten in dieser Studie wurden aufgrund ihres genetischen Hintergrundes so eingeschätzt, dass sie höchstwahrscheinlich eine SMA des Typs I oder II entwickeln werden. Das mediane Alter bei der ersten Dosisgabe war 22 Tage.
Bei der Baseline betrug die mediane Anzahl der erreichten motorischen Meilensteine 3 (zwischen 0 und 7), das mediane Gesamtergebnis in CHOP INTEND betrug 50,0 (zwischen 25 und 60) und die mediane CMAP-Amplitude des Nervus ulnaris zum Baseline-Zeitpunkt betrug 2,65 mV (1,0 - 6,7).
Die letzte Interim-Analyse (Stichtag 15. Mai 2018) wurde durchgeführt, als die Patienten im Median 27,1 Monate (15,1 – 35,5 Monate) in die Studie eingeschlossen waren und beim letzten Studienbesuch ein Durchschnittsalter von 26,0 Monaten hatten (14,0 – 34,4 Monate). Zum Zeitpunkt der Interim-Analyse lebten alle 25 Patienten ohne permanente Beatmung (2 SMN2-Gen-Kopien, n = 15; 3 SMN2-Gen-Kopien, n = 10). Der primäre Endpunkt war die Dauer des Zeitraums bis zum Tod oder bis zu einer respiratorischen Intervention (definiert als invasive oder nicht-invasive Beatmung für ≥6 Stunden/Tag kontinuierlich an ≥7 aufeinander folgenden Tagen ODER Tracheostomie) und konnte aufgrund zu weniger Ereignisse nicht bestimmt werden. Vier Patienten (2 SMN2-Kopien) benötigten aufgrund einer akuten reversiblen Erkrankung als unterstützende Massnahme für > 6 Stunden/Tag über einen Zeitraum von ≥7 Tagen Beatmung.
Die Patienten erreichten Meilensteine, die man bei einer SMA des Typs I oder II nicht erwarten würde und die eher denen einer normalen Entwicklung entsprachen. Bei der Zwischenanalyse hatten alle 25 (100 %) Patienten den motorischen WHO-Meilenstein freies Sitzen, sowie 22 (88 %) Patienten den Meilenstein Laufen mit Unterstützung erreicht. Von den Patienten, die älter als das von der WHO definierte Zeitfenster für das erwartete Leistungsalter (95. Perzentile) waren, konnten 17 von 22 (77 %) ohne Unterstützung laufen. Der mittlere CHOP-INTEND-Score betrug bei der letzten Untersuchung bei Patienten mit 2 SMN2-Kopien 61,0 (46 - 64) und bei Patienten mit 3 SMN2-Kopien 62,6 (58 - 64). Alle Patienten konnten bei der letzten Untersuchung saugen und schlucken; 22 der 25 Säuglinge (88 %) erzielten im HINE Abschnitt 1 die maximale Punktzahl.
Von den Patienten, die bis zur Interim-Analyse den Studienvisitentag 700 (n = 16) erreicht hatten, wurde der Anteil bewertet, der eine klinisch manifeste SMA entwickelte. Die im Prüfplan definierten Kriterien für eine klinisch manifeste SMA waren ein altersangepasstes Körpergewicht unterhalb der fünften Perzentile gemäss WHO, eine Abnahme um 2 oder mehr entscheidenden Kurvenperzentilen der Gewichtszunahme, das Legen einer perkutanen Magensonde und/oder die Unfähigkeit, einen der erwarteten altersentsprechenden WHO-Meilensteine (freies Sitzen, Stehen mit Hilfe und auf Händen und Knien krabbeln, Laufen mit Unterstützung, freies Stehen, Laufen ohne Unterstützung) zu erreichen. Am Tag 700 erreichten 7 der 11 Patienten (64 %) mit 2 SMN2-Kopien und keiner der 5 Patienten mit 3 SMN2-Kopien die im Prüfplan definierten Kriterien für eine klinisch manifestierte SMA. Diese Patienten zeigten jedoch eine Gewichtszunahme und erreichten WHO-Meilensteine, die bei einer SMA Typ I normalerweise nicht erreicht werden.
Abbildung 2: Veränderung der motorischen Meilensteine gemäss HINE versus Studientage für die Studien CS3B (Spinraza- und Sham-Kontrolle), CS3A, CS5 und CS11 (ITT-Population)
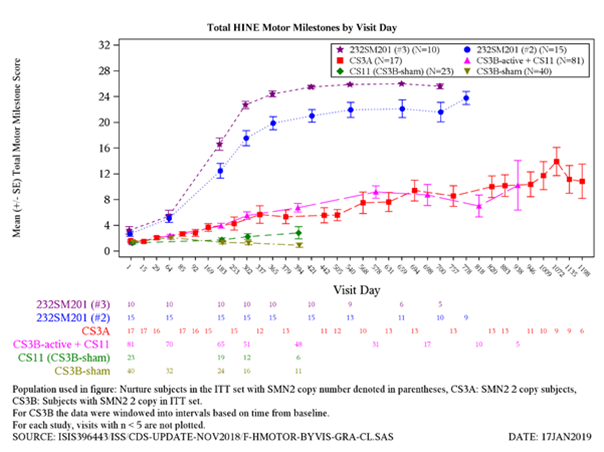
Abbildung 3: CHOP INTEND Score versus Studientage für die Studien CS3B (Spinraza und Sham-Kontrolle), CS3A, CS5 und CS11 (ITT-Population)
Weiterführung der Therapie bei Patienten mit SMA Typ II oder III ins Erwachsenenalter
Eine Zwischenauswertung liefert limitierte klinische Studiendaten von 7 jungen Erwachsenen mit SMA Typ II oder III (im Alter von 18,8 – 22,5 Jahren) mit Behandlungsbeginn als Adoleszente, die 5,3 – 6,8 Jahre in der CS2/CS12/SHINE-Studie beobachtet wurden, und weist auf eine Stabilisierung oder Verbesserung der motorischen Funktionen in diesen Patienten hin, wie der 6-Minuten-Gehtest (6MWT) und HFMSE zeigten.
Ergebnisse aus der Anwendung nach Markteinführung bei Erwachsenen
Literaturberichte von Beobachtungsstudien zur Anwendung von Nusinersen bei Patienten mit SMA Typ II und III und Therapiebeginn im Erwachsenenalter und einem Follow-Up über 10 bis 14 Monate, weisen auf eine Stabilisierung oder Verbesserung der motorischen Funktionen (HFMSE, 6MWT, RULM) bei Patienten verschiedenen Alters mit unterschiedlich schwerwiegendem Krankheitsverlauf hin, während bei unbehandelten SMA Patienten eine Abnahme der motorischen Funktion im Laufe der Zeit berichtet wurde.
Es liegen keine kontrollierten klinischen Daten vor.
|



