Eigenschaften/WirkungenATC-Code
R03AL08
Wirkungsmechanismus
Fluticasonfuroat, Umeclidinium und Vilanterol sind Vertreter dreier unterschiedlicher Arzneimittelklassen: ein synthetisches Kortikosteroid, ein langwirksamer Muskarinrezeptorantagonist (auch als LAMA oder Anticholinergikum bezeichnet) und ein selektiver, langwirksamer Beta2-adrenerger Agonist.
Fluticasonfuroat (FF)
FF ist ein Kortikosteroid mit hochpotenter antiinflammatorischer Wirksamkeit. Der genaue Wirkmechanismus, über den FF die COPD-Symptomatik beeinflusst, ist nicht bekannt. Kortikosteroide haben nachweislich ein breites Wirkungsspektrum auf unterschiedliche Zellarten (z.B. Eosinophile, Makrophagen, Lymphozyten) und Mediatoren (z.B. die am Entzündungsgeschehen beteiligten Zytokine und Chemokine).
Umeclidinium (UMEC)
Umeclidinium ist ein langwirksamer Muskarin-Rezeptor-Antagonist (bzw. ein Anticholinergikum). Umeclidinium wirkt bronchodilatatorisch durch kompetitive Hemmung der Bindung von Acetylcholin an muskarinischen Acetylcholinrezeptoren der glatten Muskulatur der Atemwege. Es zeigt in vitro eine langsame Reversibilität am menschlichen muskarinischen Rezeptor vom Subtyp M3 und in vivo in präklinischen Modellen eine lange Wirkdauer bei direkter Lungenanwendung.
Vilanterol (VI)
VI ist ein selektiver, langwirkender Beta-2-adrenerger Agonist (LABA).
Die pharmakologischen Wirkungen von Beta-2-adrenergen Agonisten wie VI beruhen zumindest teilweise auf der Stimulation der intrazellulären Adenylatzyklase, dem Enzym, das die Umwandlung von Adenosintriphosphat (ATP) zu zyklischem Adenosin-3′,5′-monophosphat (cAMP) katalysiert. Erhöhte cAMP-Konzentrationen bewirken eine Entspannung der glatten Bronchialmuskulatur und hemmen die Freisetzung von Mediatoren der Überempfindlichkeitsreaktionen vom Soforttyp aus Zellen, insbesondere aus Mastzellen.
Pharmakodynamik
Kardiovaskuläre Effekte
Die Wirkung von Fluticasonfuroat/Umeclidinium/Vilanterol auf das QT-Intervall wurde nicht in einer speziellen («thorough») QT-Studie (TQT) untersucht. TQT-Studien zu FF/VI und UMEC/VI zeigten bei klinischen Dosen von FF, UMEC und VI keine klinisch relevanten Wirkungen auf das QT-Intervall (siehe unten).
Die Wirkung von Umeclidinium/Vilanterol auf das QT-Intervall wurde in einer Placebo- und Moxifloxacin-kontrollierten QT-Studie mit einmal täglicher Gabe von Umeclidinium/Vilanterol 125/25 µg oder 500/100 µg über 10 Tage an 103 gesunden Probanden untersucht. Die maximale mittlere Differenz bei Verlängerungen des QT-Intervalls (korrigiert nach der Fridericia-Methode, QTcF) gegenüber Placebo nach Korrektur um den Ausgangswert lag bei 4,3 (90% KI=2,2 bis 6,4) Millisekunden 10 Minuten nach der Gabe von Umeclidinium/Vilanterol 125/25 µg und 8,2 (90% KI:6,2, 10,2) Millisekunden 30 Minuten nach der Gabe von Umeclidinium/Vilanterol 500/100 µg. Mit der Umeclidinium/Vilanterol 125/25-µg-Dosis wurde keine klinisch relevante Wirkung auf die Verlängerung des QT-Intervalls (korrigiert nach der Fridericia-Methode) beobachtet. Ausserdem wurden bei 281 Patienten, die Umeclidinium/Vilanterol 125/25 µg einmal täglich über 12 Monate erhielten, im 24-Stunden-Holter-Monitoring keine klinisch signifikanten Wirkungen von Umeclidinium/Vilanterol auf den Herzrhythmus beobachtet.
Die Wirkung von Fluticasonfuroat/Vilanterol auf das QT-Intervall wurde in einer doppelblinden, Placebo- und aktiv-kontrollierten Crossover-Studie mit mehreren Dosen an 85 gesunden Probanden untersucht. Die maximale mittlere Differenz (95% obere Konfidenzgrenze) des QTcF gegenüber Placebo nach Korrektur um den Ausgangswert lag bei 4,9 (7,5) Millisekunden bzw. 9,6 (12,2) Millisekunden 30 Minuten nach der Gabe von Fluticasonfuroat/Vilanterol 200/25 µg bzw. Fluticasonfuroat/Vilanterol 800/100 µg. Eine dosisabhängige Erhöhung der Herzfrequenz wurde ebenfalls beobachtet. Die maximale mittlere Differenz (95% obere Konfidenzgrenze) der Herzfrequenz gegenüber Placebo nach Korrektur um den Ausgangswert lag bei 7,8 (9,4) Schlägen/Min. bzw. 17,1 (18,7) Schlägen/Min. 10 Minuten nach der Gabe von Fluticasonfuroat/Vilanterol 200/25 µg bzw. Fluticasonfuroat/Vilanterol 800/100 µg.
Bei den zentral ausgewerteten EKGs von 911 Patienten mit COPD, die Fluticasonfuroat/Umeclidinium/Vilanterol bis zu 24 Wochen erhielten, und in einer Subgruppe von 210 Patienten, die bis zu 52 Wochen exponiert waren, wurden keine klinisch relevanten Wirkungen auf das QTc-Intervall beobachtet.
Klinische Wirksamkeit
Studie 1
Die Wirksamkeit von Fluticasonfuroat/Umeclidinium/Vilanterol (FF/UMEC/VI 100/62,5/25 µg) als einmal tägliche Behandlung bei Patienten mit einer klinischen Diagnose einer COPD wurde in einer Untergruppe von Patienten in einer 24-wöchigen aktiv kontrollierten Studie mit Verlängerung auf bis zu 52 Wochen untersucht (CTT116853, FULFIL).
Die einmal tägliche Gabe von FF/UMEC/VI 100/62,5/25 µg zeigte eine statistisch signifikante Verbesserung der Lungenfunktion (definiert als Veränderung gegenüber dem Ausgangswert des Talspiegel-FEV1 in Woche 24; ko-primärer Endpunkt) im Vergleich mit zweimal täglich verabreichtem Budesonid/Formoterol (BUD/FOR) 400/12 µg (siehe Tabelle 2). Die bronchodilatorische Wirkung von FF/UMEC/VI war ab dem ersten Behandlungstag erkennbar und blieb über die 24-wöchige Behandlungsphase erhalten.
In Woche 24 zeigte FF/UMEC/VI eine statistisch signifikante Verbesserung gegenüber BUD/FOR bei der gesundheitsbezogenen Lebensqualität (HRQoL), gemessen anhand des Gesamtscores des St George's Respiratory Questionnaire (SGRQ) (ko-primärer Endpunkt), der SGRQ-Responder-Auswertung, dem Score des COPD Assessment Test (CAT) und der CAT-Responderauswertung, der Atemsymptome gemäss des Scores und Subskalenscores der Evaluating Respiratory Symptoms in COPD Skala (E-RSTM: COPD) über die Wochen 21-24, der Atemnot auf der Grundlage des Transitional Dyspnoea Index (TDI) Focal Score in Woche 24 sowie der verwendeten Bedarfsmedikation, gemessen anhand der mittleren Zahl von Anwendungen pro Tag über die Wochen 1-24 (siehe Tabelle 1).
FF/UMEC/VI zeigte eine statistisch signifikante Reduktion bei der jährlichen Rate von mittelschweren /schweren Exazerbationen (z.B. erforderliche Behandlung mit Antibiotika oder Kortikosteroiden oder Hospitalisierung; extrapoliert aus Daten bis zu Woche 24) gegenüber BUD/FOR. Unter FF/UMEC/FI wurde eine Reduktion des Risikos einer mittelschweren/schweren Exazerbation gegenüber BUD/FOR beobachtet (auf der Grundlage der Auswertung der Zeit bis zur ersten Exazerbation) (siehe Tabelle 1).
Tabelle 1: Wichtigste Wirksamkeitsendpunkte bis zu Woche 24 (Studie CTT116853)
|
Studie CTT116853
|
FF/UMEC/VI
100/62,5/25 µg 1x tgl.
(n= 911)
|
BUD/FOR
400/12 µg 2x tgl.
(n=899)
|
Vergleich mit BUD/FOR
| |
Behandlungsunterschied
(95% KI)
p-Wert
|
Behandlungsverhältnis
(95% KI)
p-Wert
| |
Talspiegel-FEV1 (L) in Woche 24, Änderung der Kleinstquadratmittelwerte gegenüber dem Ausgangswert (SE)a, b
|
0,142 (0,0083)
|
-0,029 (0,0085)
|
0,171
(0,148, 0,194)
p<0,001
|
-
| |
SGRQ-Gesamtscore in Woche 24, Änderung der Kleinstquadratmittelwerte gegenüber dem Ausgangswert (SE)a, c
|
-6,6 (0,45)
|
-4,3 (0,46)
|
-2,2
(-3,5, -1,0)
p<0,001
|
-
| |
a
Ko-primäre Endpunkte
b Statistisch signifikanter Behandlungsunterschied für FF/UMEC/VI vs. BUD/FOR, auch in den Wochen 2, 4 und 12 beobachtet
c Statistisch signifikanter Behandlungsunterschied für FF/UMEC/VI vs. BUD/FOR, auch in Woche 4 beobachtet
Abkürzungen: 2x tgl.=zweimal täglich; BUD=Budesonid; FOR=Formoterol; KI= Konfidenzintervall; FEV1= forciertes Exspirationsvolumen in 1 Sekunde; L= Liter; µg= Mikrogramm; n= Anzahl im Intent-to-treat-Kollektiv; 1x tgl.= einmal täglich; SE= Standardfehler; SGRQ=St George's Respiratory Questionnaire;
|
Die Ergebnisse der Lungenfunktion, HRQoL, Symptome und Exazerbationen nach bis zu 52 Behandlungswochen in einer Untergruppe von Patienten (n=430) waren mit den Ergebnissen nach bis zu 24 Wochen vergleichbar.
Studie 2 (CTT116855, IMPACT)
Die langfristige Wirksamkeit von Fluticasonfuroat/Umeclidinium/Vilanterol (FF/UMEC/VI 100/62,5/25 µg) einmal täglich bei COPD-Patienten mit anamnestisch bekannten mässigen oder schweren Exazerbationen in den vorausgegangenen 12 Monaten wurde im Rahmen einer 52-wöchigen aktiv-kontrollierten Studie gegenüber den Fixkombinationen Fluticasonfuroat/Vilanterol (FF/VI 100/25 µg) und Umeclidinium/Vilanterol (UMEC/VI 62,5/25 µg) (Randomisierung im Verhältnis 2:2:1) beurteilt (Studie CTT116855, IMPACT).
Die Patienten unter Behandlung mit FF/UMEC/VI zeigten gegenüber FF/VI und UMEC/VI einen statistisch signifikanten Rückgang der jährlichen Inzidenz von mässigen/schweren Exazerbationen unter der Behandlung (primärer Endpunkt). Die Ergebnisse für den Wirksamkeitsendpunkt sind in Tabelle 2 aufgeführt.
Tabelle 2: Wichtigste Wirksamkeitsendpunkte (Studie CTT116855)
|
|
FF/UMEC/VI
(n = 4'151)
|
FF/VI
(n = 4'134)
|
UMEC/VI
(n = 2'070)
|
FF/UMEC/VI
vs. FF/VI
|
FF/UMEC/VI
vs. UMEC/VI
| |
Inzidenz mässiger/schwerer Exazerbationena
| |
Exazerbationen/Jahr
|
0,91
|
1,07
|
1,21
|
|
| |
Inzidenzrückgang (%)
|
|
|
|
15%
|
25%
| |
95%-KI
|
|
|
|
10; 20
|
19; 30
| |
p-Wert
|
|
|
|
p <0,001
|
p <0,001
| |
Zeit bis zur ersten mässigen/schweren Exazerbation
| |
Patienten mit einem Ereignis (%)
|
47%
|
49%
|
50%
|
|
| |
Risikosenkung (%)
|
|
|
|
14,8%
|
16,0%
| |
95%-KI
|
|
|
|
9,3; 19,9
|
9,4; 22,1
| |
p-Wert
|
|
|
|
p <0,001
|
p <0,001
| |
Inzidenz schwerer Exazerbationen
| |
Exazerbationen/Jahr
|
0,13
|
0,15
|
0,19
|
|
| |
Inzidenzrückgang (%)
|
|
|
|
13%
|
34%
| |
95%-KI
|
|
|
|
-1; 24
|
22; 44
| |
p-Wert
|
|
|
|
p = 0,064
|
p <0,001
| |
Talspiegel-FEV1 (L) nach 52 Wochen
| |
LS-Mittelwert-Änderung gegenüber dem Ausgangswert (SE)
|
0,094
(0,004)
|
-0,003
(0,004)
|
0,040
(0,006)
|
|
| |
Behandlungsunterschied
|
|
|
|
0,097
|
0,054
| |
95%-KI
|
|
|
|
0,085; 0,109
|
0,039; 0,069
| |
p-Wert
|
|
|
|
p <0,001
|
p <0,001
| |
SGRQ-Gesamtscore in Woche 52
| |
LS-Mittelwert-Änderung gegenüber dem Ausgangswert (SE)
|
-5,5
(0,23)
|
-3,7
(0,24)
|
-3,7
(0,35)
|
|
| |
Behandlungsunterschied
|
|
|
|
-1,8
|
-1,8
| |
95%-KI
|
|
|
|
-2,4; -1,1
|
-2,6; -1,0
| |
p-Wert
|
|
|
|
p <0,001
|
p <0,001
| |
KI = Konfidenzintervall; FEV1 = forciertes exspiratorisches 1-Sekunden-Volumen; L = Liter; LS = Kleinstquadrat (least squared); n = Anzahl in der Intent-to-treat-Population; SE = Standardfehler (standard error); SGRQ = St. George's Respiratory Questionnaire.
a Primärer Endpunkt
|
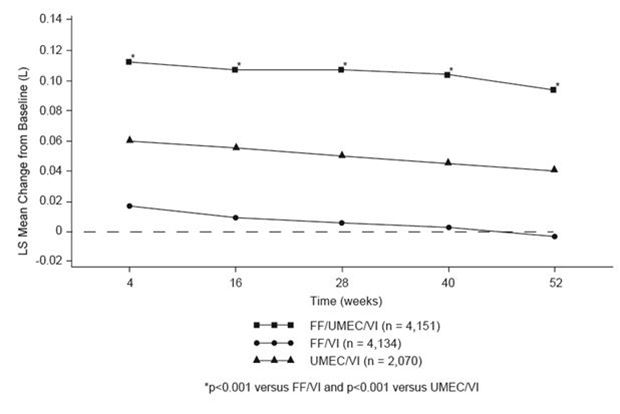
Die Wirkungen auf die Lungenfunktion, bezogen auf das Talspiegel-FEV1 (Änderung des Talspiegel-FEV1 gegenüber dem Ausgangswert), von FF/UMEC/VI im Vergleich zu FF/VI und UMEC/VI wurden zu allen Erhebungszeitpunkten im Verlauf der 52-wöchigen Studie beobachtet (siehe Abbildung 1).
Abbildung 1: Änderung des Kleinstquadrat-Mittelwerts des Talspiegel-FEV1 gegenüber dem Ausgangswert (L)
Wirksamkeit aus weiteren unterstützenden Studien
Studie 200812 war eine 24-wöchige Nichtinferioritätsstudie (n = 1055), in der Fluticasonfuroat/Umeclidinium/Vilanterol (FF/UMEC/VI 100/62,5/25 µg) aus einem Einzelinhalator und Fluticasonfuroat/Vilanterol (100/25 µg) + Umeclidinium (62,5 µg) als Mehrinhalator-Koadministrationstherapie, jeweils einmal täglich, bei Patienten mit anamnestisch bekannten mässigen bis schweren Exazerbationen in den vorausgegangenen 12 Monaten verglichen wurden. In dieser Studie war FF/UMEC/VI nicht inferior vs FF/VI + UMEC in Bezug auf die Verbesserung der Baseline Talspiegel-FEV1 in Woche 24. Die vorgegebene Nichtinferioritätsschwelle lag bei 50 ml.
Umeclidinium mit Fluticasonfuroat/Vilanterol
In zwei 12-wöchigen, placebokontrollierten Studien (200109 und 200110) führte Umeclidinium (62,5 µg) zusätzlich zu Fluticasonfuroat/Vilanterol (FF/VI) (100/25 µg) einmal täglich gegenüber Placebo plus FF/VI bei erwachsenen Patienten mit klinisch diagnostizierter COPD zu statistisch signifikanten und klinisch relevanten Verbesserungen im primären Endpunkt des Talspiegel-FEV1 an Tag 85 (124 ml [95%-KI: 93; 154]; p<0,001) in Studie 200109 und 122 ml [95% KI: 91, 152, p<0,001] in Studie 200110).
12-monatige Studie mit Fluticasonfuroat/Vilanterol
In zwei 52-wöchigen randomisierten, doppelblinden Parallelgruppenstudien (HZC102970 und HZC102871) wurde die jährliche Rate mittelschwerer bis schwerer Exazerbationen pro Jahr bei Patienten mit klinischer COPD-Diagnose verglichen, die mit FF/VI oder mit Vilanterol einmal täglich behandelt wurden. Die Ergebnisse einer integrierten Auswertung beider Studien zeigten, dass die Behandlung mit FF/VI 100/25 µg einmal täglich zu einer 27%igen Reduktion der jährlichen Rate von mittelschweren/schweren COPD-Exazerbationen gegenüber Vilanterol führten (95% KI: 16, 37 [p<0,001]). Reduktionen des Risikos mittelschwerer/schwerer Exazerbationen (basierend auf der Auswertung der Zeit bis zur ersten Exazerbation) und der Rate der Exazerbationen, die den Einsatz von Kortikosteroiden erfordern, wurden auch unter einmal täglich FF/VI 100/25 µg gegenüber Vilanterol beobachtet.
|

