Eigenschaften/WirkungenATC-Code
N07XX11
Wirkungsmechanismus
Pitolisant ist ein starker, oral wirksamer Histamin-H3-Rezeptor-Antagonist/inverser Agonist des Histamin-H3-Rezeptors, der mittels Blockierung der Histamin-Autorezeptoren die Aktivität von histaminergen Neuronen im Gehirn, einem wichtigen Erregungssystem mit weitläufigen Projektionen in das gesamte Gehirn, verstärkt. Darüber hinaus moduliert Pitolisant verschiedene Neurotransmittersysteme und erhöht dadurch die Ausschüttung von Acetylcholin, Noradrenalin und Dopamin im Gehirn. Eine erhöhte Ausschüttung von Dopamin im Striatum, einschliesslich des Nucleus accumbens, wurde im Zusammenhang mit Pitolisant hingegen nicht nachgewiesen.
Pharmakodynamik
Bei Patienten mit Narkolepsie mit oder ohne Kataplexie verbessert Pitolisant den Grad und die Dauer der Wachheit und die Aufmerksamkeit tagsüber, bewertet anhand objektiver Messgrössen hinsichtlich der Fähigkeit, Wachheit (z. B. Multipler Wachbleibetest, MWT) und Aufmerksamkeit (Sustained Attention to Response Task, SART) aufrecht zu erhalten.
Klinische Wirksamkeit
Erwachsene
Bei Narkolepsie (mit oder ohne Kataplexie) handelt es sich um eine chronische Erkrankung. Die Wirksamkeit von Pitolisant bei einer Dosierung von bis zu 36 mg einmal täglich zur Behandlung von Narkolepsie mit oder ohne Kataplexie wurde in zwei 8-wöchigen Hauptstudien, nämlich in den multizentrischen, randomisierten, doppelblinden, placebokontrollierten Parallelgruppenstudien Harmony I und Harmony CTP, nachgewiesen. In Harmony Ibis, einer Studie mit einem ähnlichen Design, war die Dosis auf 18 mg einmal täglich begrenzt. Die Langzeitsicherheitsdaten von Pitolisant bei dieser Indikation sind in der offenen Langzeitstudie HARMONY III verfügbar.
Die Zulassungsstudie (Harmony I) mit flexibler Dosisanpassung, in der das Prüfpräparat mit Placebo und Modafinil (400 mg/Tag) verglichen wurde, umfasste 94 Patienten (31 Patienten wurden mit Pitolisant behandelt, 30 mit Placebo und 33 mit Modafinil). Die Anfangsdosis betrug 9 mg einmal täglich und wurde entsprechend der Wirksamkeit, dem Ansprechen und der Verträglichkeit in Abständen von einer Woche auf 18 mg bzw. 36 mg einmal täglich erhöht. Die meisten Patienten (60 %) erreichten eine Dosierung von 36 mg einmal täglich. Um die Wirksamkeit von Pitolisant auf die exzessive Tagesschläfrigkeit zu beurteilen, wurde der Score (Punktwert) auf dem Epworth-Test zur Tagesschläfrigkeit (Epworth Sleepiness Scale; ESS) als primäres Wirksamkeitskriterium herangezogen. Die Ergebnisse bei Anwendung von Pitolisant waren jenen in der Placebogruppe signifikant überlegen (mittlerer Unterschied: -3,33; 95%-KI [-5,83 bis - 0,83]; p <0,05), unterschied sich jedoch nicht signifikant von den Ergebnissen in der Modafinil- Gruppe (mittlerer Unterschied: 0,12; 95%-KI [-2,5 bis 2,7]). Für die beiden wirkstoffhaltigen Substanzen wurde ein ähnlicher wachheitsfördernder Effekt ermittelt (Abbildung 1).
Abbildung 1: Veränderungen des Punktwertes im Epworth-Test zur Tagesschläfrigkeit (Epworth Sleepiness Scale; ESS) (Mittelwert ± Standardfehler des Mittelwerts [SEM]) von der Baseline bis Woche 8 in der Studie Harmony I
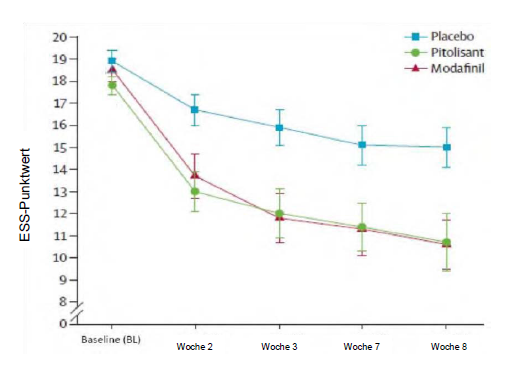
Die Auswirkungen auf die Ergebnisse im Epworth-Test wurden durch zwei Laboruntersuchungen zur Wachsamkeit und Aufmerksamkeit (Multipler Wachbleibetest, MWT) (p=0,044) und Sustained Attention to Response Task (SART) (p=0,053) gestützt.
Die Häufigkeit der Kataplexie-Attacken bei Patienten mit diesem Symptom wurde im Vergleich zu Placebo (-10 %) bei Anwendung von Pitolisant (-65 %) signifikant (p=0,034) reduziert. Die tägliche Inzidenz von Kataplexien (geometrische Mittel) betrug bei Pitolisant zur Baseline 0,52 und zur abschliessenden Studienvisite 0,18 bzw. bei Placebo zur Baseline 0,43 und zur abschliessenden Studienvisite 0,39; die relative Rate (rR) betrug 0,38 [0,16; 0,93] (p=0,034).
An der zweiten Zulassungsstudie (Harmony Ibis) nahmen 165 Patienten teil; 67 Patienten wurden mit Pitolisant, 33 mit Placebo und 65 mit Modafinil behandelt. Das Studiendesign ähnelte jenem der Studie Harmony I; der einzige Unterschied war, dass die Höchstdosis für Pitolisant, die von 75 % der Patienten erreicht wurde, 18 mg einmal täglich statt 36 mg einmal täglich (wie in der Studie Harmony I) betrug. Da ein erhebliches Ungleichgewicht zum Vergleich von Ergebnissen mit oder ohne Clustergruppierung von Prüfzentren führte, zeigte der konservativste Ansatz für Pitolisant im Vergleich zu Placebo eine nicht signifikante Reduzierung des ESS-Score (Pitolisant-Placebo = -1,94; p=0,065). Die Ergebnisse zur Inzidenz von Kataplexien bei einer Dosis von 18 mg einmal täglich standen nicht im Einklang mit jenen der ersten Zulassungsstudie (36 mg einmal täglich).
Bei den beiden objektiven Tests zur Wachsamkeit und Aufmerksamkeit, MWT und SART, wurde unter Pitolisant im Vergleich zu Placebo eine signifikante Verbesserung (p=0,009 bzw. p=0,002) und im Vergleich zu Modafinil eine nicht signifikante Verbesserung (p=0,713 bzw. p=0,294) festgestellt.
Das Design von Harmony CTP, der dritten doppelblinden, randomisierten Parallelgruppen-Zulassungsstudie zum Vergleich von Pitolisant mit Placebo, war darauf ausgelegt, die Wirksamkeit von Pitolisant bei Narkolepsie-Patienten mit häufig auftretender Kataplexie nachzuweisen. Der primäre Wirksamkeitsendpunkt war die Veränderung der durchschnittlichen Anzahl an Kataplexie-Attacken pro Woche zwischen der 2-wöchigen Baseline und dem 4-wöchigen Zeitraum mit stabiler Behandlung zum Ende der Studie. In die Studie wurden 105 Narkolepsie- Patienten mit häufigen wöchentlichen Kataplexie-Attacken zum Baselinezeitpunkt aufgenommen (54 Patienten wurden mit Pitolisant behandelt und 51 mit Placebo). Die Anfangsdosis betrug 4,5 mg einmal täglich und wurde entsprechend der Wirksamkeit, dem Ansprechen und der Verträglichkeit in Abständen von einer Woche auf 9 mg, 18 mg bzw. 36 mg einmal täglich erhöht. Die meisten Patienten (65 %) erreichten eine Dosierung von 36 mg einmal täglich.
Hinsichtlich des primären Wirksamkeitsendpunkts, der wöchentlichen Inzidenz von Kataplexie- Episoden (Weekly Rate of Cataplexy; WRC), waren die Ergebnisse von Pitolisant jenen aus der Placebogruppe signifikant überlegen (p <0,0001), mit einer progressiven Reduzierung von der Baseline bis zum Behandlungsende von 64 % (Abbildung 2). Zum Baselinezeitpunkt betrug das geometrische Mittel der WRC in der Placebo- bzw. in der Pitolisant-Gruppe 7,31 (Median = 6,5 [4,5;12) und 9,15 (Median = 8,5 [5,5; 15,5]). Während des Behandlungszeitraums mit stabiler Dosisgabe (bis zum Ende der Behandlung) verringerte sich bei Patienten, bei denen mindestens eine Kataplexie- Episode aufgetreten war, das geometrische Mittel der WRC in der Placebo- und in der Pitolisant- Gruppe auf 6,79 (Median = 6 [3; 15]) bzw. 3,28 [Median = 3 [1,3; 6]). Die beobachtete WRC in der Pitolisant-Gruppe betrug etwa die Hälfte der WRC in der Placebo-Gruppe; die Effektgrösse von Pitolisant im Vergleich zu Placebo wurde durch die relative Rate (rR (Pt/Pb), rR=0,512; 95%-KI [0,435 bis 0,603]; p <0,0001) zusammengefasst.
Abbildung 2: Veränderung der wöchentlichen Kataplexie-Episoden (geometrisches Mittel) von Baseline bis Woche 7 in der Studie Harmony CTP
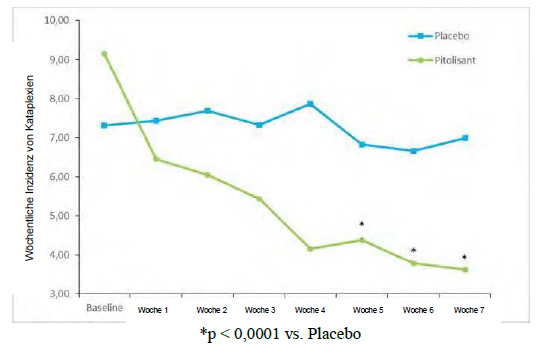
Die Wirkung von Pitolisant auf die exzessive Tagesschläfrigkeit wurde in diesem Kollektiv ausserdem anhand des ESS-Punktwerts beurteilt. In der Pitolisant-Gruppe verringerte sich der ESS-Punktwert im Vergleich zu Placebo signifikant zwischen Baseline und dem Behandlungsende, mit einer beobachteten mittleren Veränderung von -1,9 ± 4,3 und -5,4 ± 4,3 (Mittelwert ± Standardabweichung) bei Placebo bzw. Pitolisant (p <0,0001). Die Wirkung auf die exzessive Tagesschläfrigkeit wurde durch die Ergebnisse im Multiplen Wachbleibetest (MWT) bestätigt. Das geometrische Mittel der Verhältnisse (MWTStudienende/MWTBaseline) betrug 1,8 (95%-KI 1,19; 2,71, p=0,005). Der MWT-Wert in der Pitolisant-Gruppe war um 80 % höher als in der Placebo-Gruppe.
In der offenen Phase-III-Langzeitstudie (HARMONY III) wurde die Langzeitsicherheit von Pitolisant bei Patienten mit Narkolepsie (mit oder ohne Kataplexie) über 12 Monate und mit einer Verlängerung von bis zu 5 Jahren untersucht. 102 narkoleptische Patienten mit oder ohne Kataplexie wurden in die 12-monatige Nachbeobachtungszeit eingeschlossen. 68 Patienten führten die ersten 12 Monate zu Ende. 45, 38, 34 und 14 Patienten führten die Nachbeobachtungszeiträume von 2, 3, 4 bzw. 5 Jahren zu Ende.
Die Höchstdosis, die während der Studie verabreicht wurde, betrug bei 85 % der Patienten 36 mg/Tag. Nach 12-monatiger Behandlung sind die Verbesserungen bei der exzessiven Tagesschläfrigkeit, die anhand des ESS-Punktwerts der verbleibenden Patienten ermittelt wurden, gleich hoch wie in den anderen Studien, die bei narkoleptischen Patienten durchgeführt wurden. Die Abnahme des mittleren ESS-Punktwerts (Standardabweichung) belief sich nach 1 Jahr auf -3,62 (4,63).
Nach 12-monatiger Behandlung mit Pitolisant hat sich die Häufigkeit von Symptomen wie Schlafattacken, Schlaflähmung, Kataplexie und Halluzinationen verbessert.
Es wurden keine grösseren Sicherheitsbedenken festgestellt. Die beobachteten Sicherheitsergebnisse waren ähnlich wie in früheren Studien, in denen Pitolisant mit 36 mg einmal täglich nur bis zu 3 Monate lang verabreicht wurde.
Pädiatrische Population
Die Wirksamkeit von Pitolisant bis zu einer Dosis von 36 mg einmal täglich wurde für die Behandlung von Narkolepsie mit oder ohne Kataplexie bei Kindern im Alter von 6 bis unter 18 Jahren im Rahmen einer 8-wöchigen, multizentrischen, randomisierten, doppelblinden, placebokontrollierten Parallelgruppenstudie untersucht. Die Studie umfasste 110 Patienten (72 Patienten in der Pitolisant-Gruppe, 38 Patienten in der Placebo-Gruppe). Die Anfangsdosis betrug 4,5 mg einmal täglich und wurde entsprechend der Wirksamkeit, dem Ansprechen und der Verträglichkeit in Abständen von 1 Woche auf 18 mg bzw. 36 mg einmal täglich erhöht. Bei Patienten mit einem Körpergewicht von weniger als 40 kg wurde eine Höchstdosis von 18 mg beibehalten. Die meisten Patienten (60 %) erreichten eine Dosierung von 36 mg einmal täglich. 35 Patienten (31,8 %) waren 6 bis 11 Jahre alt und 75 Patienten (68,2 %) waren 12 bis unter 18 Jahre alt. Um die Wirksamkeit von Pitolisant bei übermässiger Schläfrigkeit während des Tages (Excessive Daytime Sleepiness, EDS) und Kataplexie (Cateplexy, CTP) zu beurteilen, wurde der Gesamt-Punktwert auf der Ullanlinna Narcolepsy Scale (UNS) als primäres Wirksamkeitskriterium herangezogen, das als Veränderung vom Studienbeginn bis zum Ende des doppelblinden Zeitraums bewertet wurde. Der geschätzte Unterschied des Kleinste-Quadrate-Mittelwerts (SE, Standardfehler) [95-%-KI] auf der UNS zwischen den Behandlungsgruppen (Pitolisant minus Placebo) betrug -3,69 (1,37) [-6,38; -0,99], p = 0,0073. Sekundäre Endpunkte waren die Paediatric Daytime Sleepiness Scale (Skala zur Tagesschläfrigkeit bei Kindern und Jugendlichen, PDSS), der UNScataplexy (CTP) subscore und die wöchentliche Kataplexierate (Weekly Rate of Cataplexy, WRC). Der geschätzte Unterschied des Kleinste-Quadrate-Mittelwerts (SE, Standardfehler) [95-%-KI] beim PDSS-Gesamt-Punktwert zwischen den Behandlungsgruppen (Pitolisant minus Placebo) betrug -3,41 (1,07) [-5,52; -1,31], p = 0,0015. In der Untergruppe der Patienten mit Narkolepsie Typ 1, für die bei Aufnahme in die Studie kein Mindestmass an Kataplexie erforderlich war (n = 61 in der Pitolisant-Gruppe; n = 29 in der Placebo-Gruppe), betrug der geschätzte Unterschied des Kleinste-Quadrate-Mittelwerts (SE, Standardfehler) [95% KI] des UNS-CTP-Subscores zwischen den Behandlungsgruppen (Pitolisant minus Placebo) -1,77 (0,78) [-3,29; -0,24], p=0,0229, und das Ratenverhältnis zwischen der WRC in der Pitolisant-Gruppe und der WRC in der Placebo-Gruppe fiel, bereinigt um den Ausgangswert, zugunsten von Pitolisant aus (0,42 [95-%-KI: 0,18; 1,01], p = 0,0540).
Tabelle 1: Übersicht über die Ergebnisse der Wirksamkeit nach 8 Wochen in der pädiatrischen Phase-3-Studie
|
|
Placebo (n = 38)
|
Pitolisant (n = 72)
| |
Ullanlinna Narcolepsy Scale (UNS)
| |
Gesamtergebnis
| |
Mittelwert bei Studienbeginn (SD)
Mittelwert am Ende der Behandlung (SD)
Kleinste-Quadrate-Mittelwert (SE) – Veränderung gegenüber dem Ausgangswert
Schätzung, 95% KI
p-Wert
|
23.68 (9.08)
21.77 (9.25)
-2.60 (1.35)
|
24.63 (7.80)
18.23 (8.14)
-6.29 (1.14)
-3.69 (-6.38; -0.99)
0.0073
| |
Paediatric Daytime Sleepiness Score (PDSS)
| |
Mittelwert bei Studienbeginn (SD)
Mittelwert am Ende der Behandlung (SD)
Kleinste-Quadrate-Mittelwert (SE) – Veränderung gegenüber dem Ausgangswert
Schätzung, 95% KI
p-Wert
|
20.00 (3.49)
17.96 (5.60)
-2.11 (0.89)
|
20.16 (3.64)
14.57 (5.37)
-5.53 (0.66)
-3.41 (-5.52; -1.31)
0.0015
| |
|
Placebo (n = 29)
|
Pitolisant (n = 61)
| |
UNS-Cataplexy Subscore*
| |
Mittelwert bei Studienbeginn (SD)
Mittelwert am Ende der Behandlung (SD)
Kleinste-Quadrate-Mittelwert (SE) – Veränderung gegenüber dem Ausgangswert
Schätzung, 95% KI
p-Wert
|
9.03 (4.33)
8.07 (4.62)
-1.12 (0.64)
|
8.93 (3.96)
6.02 (4.00)
-2.88 (0.44)
-1.77 (-3.29; -0.24)
0.0229
| |
Weekly Rate of Cataplexy, WRC*
| |
Mittelwert bei Studienbeginn (SD)
Kleinste-Quadrate-Mittelwert (SE)
Schätzung, 95% KI
p-Wert
|
13.44 (26.92)
5.05 (0.37)
|
8.63 (17.73)
2.14 (0.27)
0.42 (0.18; 1.01)
0.0540
|
*nur bei Patienten mit Narkolepsie Typ I bestimmt
SD: Standardabweichung (standard deviation); SE: Standardfehler (standard error); KI: Konfidenzintervall
Abbildung 3: Veränderung des mittleren Gesamt-Punktwerts auf der Ullanlinna Narcolepsy Scale (Mittelwert ± SEM) vom Studienbeginn bis zum Ende der Behandlung (vollständiges Analyseset)
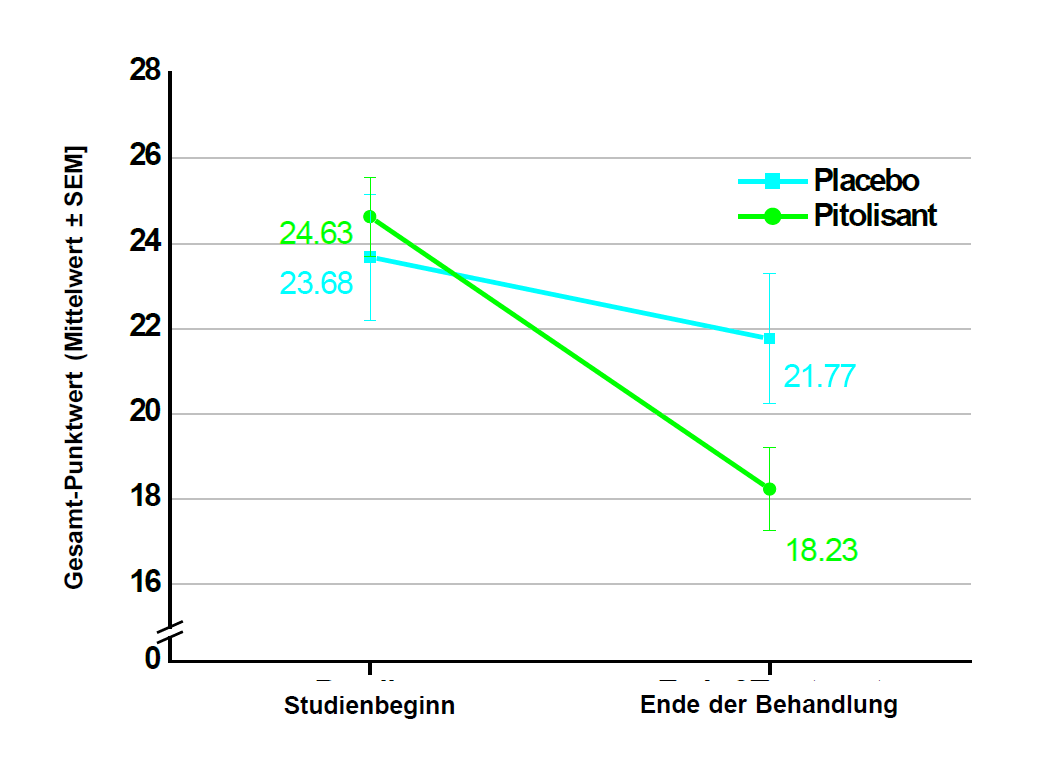
Studienbeginn = [V1-Punktwert (T -14) + V2-Punktwert (T 0)]/2
Ende der Behandlung = [V6-Punktwert (T 49) + V7-Punktwert (T 56)]/2
SEM = Standardfehler des Mittelwerts
|



