ZusammensetzungWirkstoffe
Neratinib als Neratinib Maleat
Hilfsstoffe
Mannitol (E421), mikrokristalline Cellulose, Crospovidon, Povidon K25, hochdisperses Siliciumdioxid (wasserfrei), Magnesiumstearat, Polyvinylalkohol, Titandioxid (E171), Macrogol 3350, Talkum, Eisen(III)-oxid (E172), gereinigtes Wasser.
Indikationen/AnwendungsmöglichkeitenNerlynx ist indiziert für die erweiterte adjuvante Behandlung von erwachsenen Patienten mit Hormonrezeptor-positivem, HER2-überexprimiertem/amplifiziertem Brustkrebs in einem frühen Stadium, die eine adjuvante Behandlung auf Basis von Trastuzumab und einer Chemotherapie vor weniger als einem Jahr abgeschlossen haben (siehe Rubrik «Eigenschaften/Wirkungen»).
Dosierung/AnwendungDie Behandlung mit Nerlynx muss von einem Arzt mit Erfahrung in der Verabreichung von Krebsmedikamenten initiiert und überwacht werden.
Übliche Dosierung
Die empfohlene Tagesdosis von Nerlynx beträgt 240 mg, entsprechend sechs 40-mg-Tabletten, welche einmal täglich oral einzunehmen sind. Nerlynx sollte zusammen mit Nahrung eingenommen werden, vorzugsweise morgens. Die Behandlung muss innerhalb eines Jahres nach Abschluss der Trastuzumab-Therapie initiiert werden.
Therapiedauer
Die Therapiedauer beträgt ein Jahr ohne Unterbrechung.
Durchfallprophylaxe unter Nerlynx
Eine Durchfallprophylaxe wird während der ersten 56 Tage der Nerlynx-Behandlung empfohlen. Hierzu sollten in den ersten zwei Wochen ab dem Zeitpunkt der ersten Nerlynx-Dosis 4 mg Loperamid dreimal täglich angewendet werden, danach 4 mg zweimal täglich (Angaben zur Dosisanpassung bei Auftreten von Durchfall siehe unten, Tabelle 3).
Dosisanpassung aufgrund unerwünschter Wirkungen/Interaktionen
Es wird empfohlen, die Dosis von Nerlynx im Hinblick auf die Sicherheit und Verträglichkeit des jeweiligen Patienten anzupassen. Das Management bestimmter Nebenwirkungen kann eine Unterbrechung der Einnahme und/oder eine Verringerung der Dosis entsprechend Tabelle 1, Tabelle 2, Tabelle 3 und Tabelle 4 erforderlich machen.
Die Behandlung mit Nerlynx ist bei Patienten zu beenden, die
·sich im Hinblick auf die behandlungsbedingte Toxizität nicht auf Grad 0 bis 1 erholen,
·Toxizitäten aufweisen, die zu einer Verzögerung der Behandlung >3 Wochen führen, oder
·120 mg täglich nicht vertragen.
Weitere klinische Situationen können zu Dosisanpassungen führen, falls klinisch indiziert (z.B. intolerable Toxizitäten, persistierende Grad-2-Nebenwirkungen).
Tabelle 1: Änderungen der Nerlynx-Dosis bei Nebenwirkungen
|
Dosierung
|
Nerlynx-Dosis
| |
Empfohlene Anfangsdosis
|
240 mg täglich
| |
Erste Dosisreduktion
|
200 mg täglich
| |
Zweite Dosisreduktion
|
160 mg täglich
| |
Dritte Dosisreduktion
|
120 mg täglich
|
Tabelle 2: Nerlynx-Dosisanpassungen und -Management – allgemeine Toxizitäten*
|
Schweregrad der Toxizität†
|
Massnahme
| |
Schweregrad 3
|
Nerlynx absetzen bis zur Erholung auf Grad ≤1 oder Baseline innerhalb von 3 Wochen nach Unterbrechen der Behandlung. Danach die Nerlynx-Behandlung mit der nächstniedrigeren Dosierung fortsetzen. Wenn innerhalb von 3 Wochen keine Erholung von der Toxizität mit Schweregrad 3 eintritt, Nerlynx permanent absetzen.
| |
Schweregrad 4
|
Nerlynx permanent absetzen.
|
* Informationen zum Management von Durchfall und Lebertoxizität finden Sie in Tabelle 3 und Tabelle 4 unten.
† Gemäss CTCAE v4.0
Dosisanpassung bei Durchfall
Die Behandlung von Durchfall erfordert die korrekte Anwendung eines Durchfallmedikaments, Ernährungsänderungen und eine angemessene Änderung der Nerlynx-Dosis. Leitlinien zur Anpassung der Nerlynx-Dosis bei Durchfall finden Sie in Tabelle 3.
Tabelle 3: Dosisanpassung bei Durchfall
|
Schweregrad des Durchfalls*
|
Massnahme
| |
·Durchfall mit Schweregrad 1
[Steigerung um <4 Stuhlgänge pro Tag gegenüber Baseline]
·Durchfall mit Schweregrad 2
[Steigerung um 4-6 Stuhlgänge pro Tag gegenüber Baseline] über einen Zeitraum von <5 Tagen
·Durchfall mit Schweregrad 3
[Steigerung um ≥7 Stuhlgänge pro Tag gegenüber Baseline; Inkontinenz; Krankenhauseinweisung indiziert; eingeschränkte Möglichkeit der Eigenversorgungstätigkeiten des täglichen Lebens] über einen Zeitraum von ≤2 Tagen
|
·Durchfallbehandlung dem Schweregrad des Durchfalls entsprechend anpassen.
·Ernährung ändern.
·Flüssigkeitsaufnahme von etwa 2 l/Tag sicherstellen, um Dehydratation zu vermeiden.
·Bei Verbesserung des Zustands auf Schweregrad ≤1 oder Baseline ggf. erneute Durchfallprophylaxe bei jeder nachfolgenden Nerlynx-Einnahme in Betracht ziehen (siehe Rubrik «Warnhinweise und Vorsichtsmassnahmen»).
| |
·Jeder Schweregrad mit Komplikationen†
·Durchfall mit Schweregrad 2, der 5 Tage oder länger anhält‡
·Durchfall mit Schweregrad 3, der zwischen 2 Tagen und 3 Wochen anhält‡
|
·Nerlynx-Behandlung unterbrechen.
·Ernährung ändern.
·Flüssigkeitsaufnahme von etwa 2 l/Tag sicherstellen, um Dehydratation zu vermeiden.
·Wenn in einer Woche oder weniger eine Erholung auf Durchfall mit Schweregrad ≤1 eintritt, Nerlynx-Behandlung mit derselben Dosis fortsetzen.
·Wenn es länger als eine Woche dauert, bis eine Erholung auf Durchfall mit Schweregrad ≤1 eintritt, Nerlynx-Behandlung mit verminderter Dosis fortsetzen (siehe Tabelle 1).
·Bei Verbesserung des Zustands auf Schweregrad ≤1 oder Baseline ggf. erneute Durchfallprophylaxe bei jeder nachfolgenden Nerlynx-Einnahme in Betracht ziehen (siehe Rubrik «Warnhinweise und Vorsichtsmassnahmen»).
·Wenn Durchfall mit Schweregrad 3 länger als 3 Wochen anhält, Nerlynx permanent absetzen.
| |
·Durchfall mit Schweregrad 4 [lebensbedrohliche Folgen; Notfalleingriff indiziert]
|
·Nerlynx permanent absetzen.
| |
·Rückfall auf Durchfall mit Schweregrad 2 oder höher bei 120 mg pro Tag
|
·Nerlynx permanent absetzen.
|
* Gemäss CTCAE v4.0
† Komplikationen umfassen Dehydratation, Fieber, Hypotonie, Niereninsuffizienz oder Neutropenie mit Schweregrad 3 oder 4
‡ Trotz optimaler medizinischer Behandlung
Dosisanpassungen bei Lebertoxizität
Leitlinien zur Anpassung der Nerlynx-Dosis im Fall von Lebertoxizität finden Sie in Tabelle 4 (siehe Rubrik «Warnhinweise und Vorsichtsmassnahmen»).
Tabelle 4: Dosisanpassungen bei Lebertoxizität
|
Schweregrad der Lebertoxizität*
|
Massnahme
| |
·ALT Schweregrad 3 (>5–20 x ULN)
ODER
·Bilirubin Schweregrad 3 (>3–10 x ULN)
|
·Nerlynx absetzen bis zur Erholung auf Schweregrad ≤1.
·Alternative Ursachen beurteilen.
·Bei Erholung auf Schweregrad ≤1 innerhalb von 3 Wochen Nerlynx-Behandlung mit der nächstniedrigeren Dosis fortsetzen. Wenn trotz Dosisreduktion erneut ALT oder Bilirubin mit Schweregrad 3 auftritt, Nerlynx permanent absetzen.
| |
·ALT Schweregrad 4 (>20 x ULN)
ODER
·Bilirubin Schweregrad 4 (>10 x ULN)
|
·Nerlynx permanent absetzen.
·Alternative Ursachen beurteilen.
|
ULN = Oberer Normgrenzwert; ALT = Alaninaminotransferase
* Gemäss CTCAE v4.0
Spezielle Dosierungsanweisungen
Verwendung von CYP3A4-/P-gp-Hemmern
Wenn die Hemmer nicht vermieden werden können, ist die Nerlynx-Dosis
·auf eine einmalige tägliche Einnahme von 40 mg (eine einzelne 40 mg-Tablette) zu reduzieren und zusammen mit einem starken CYP3A4-/P-gp-Hemmer einzunehmen.
·im Falle der gleichzeitigen Einnahme mit einem moderaten CYP3A4-/P-gp-Hemmer auf 40 mg einmal täglich (eine Tablette) zu reduzieren und bei guter Verträglichkeit auf 80 mg für mindestens 1 Woche, dann auf 120 mg für mindestens 1 Woche und anschliessend auf 160 mg als maximale Tagesdosis erhöhen. Der Patient sollte sorgfältig überwacht werden, insbesondere bezüglich der Wirkung auf den Gastrointestinaltrakt, einschliesslich Durchfall und Lebertoxizität.
Nach der Absetzung des starken oder moderaten CYP3A4-/P-gp-Hemmers ist mit der vorherigen Dosis von Nerlynx 240 mg fortzufahren (siehe Rubriken «Warnhinweise und Vorsichtsmassnahmen», «Interaktionen» und «Pharmakokinetik»).
Grapefruit und Granatapfel
Die gleichzeitige Verabreichung von Neratinib mit Grapefruit oder Granatapfel/ Grapefruit- oder Granatapfelsaft wird nicht empfohlen (siehe Rubriken «Warnhinweise und Vorsichtsmassnahmen» und «Interaktionen»).
H2-Rezeptor-Antagonisten und Antazida
Wenn H2-Rezeptor-Antagonisten verwendet werden, sollte Nerlynx mindestens 2 Stunden vor oder 10 Stunden nach der Einnahme des H2-Rezeptor-Antagonisten eingenommen werden. Zwischen der Einnahme einer Nerlynx-Dosis und der Einnahme von Antazida sollten mindestens 3 Stunden liegen (siehe Rubriken «Warnhinweise und Vorsichtsmassnahmen», «Interaktionen» und «Pharmakokinetik»).
Patienten mit Leberfunktionsstörungen
Bei Patienten mit leichter bis mittelschwerer Leberfunktionsstörung (Child-Pugh-Klasse A oder B) ist keine Dosisanpassung erforderlich (siehe Rubrik «Pharmakokinetik»).
Patienten mit Nierenfunktionsstörungen
Bei Patienten mit leichter bis mittelschwerer Nierenfunktionsstörung ist keine Dosisanpassung erforderlich. Nerlynx wurde nicht bei Patienten mit schwerer Nierenfunktionsstörung, einschliesslich Dialysepatienten, getestet. Die Behandlung von Patienten mit schwerer Nierenfunktionsstörung oder Dialysepatienten wird nicht empfohlen (siehe Rubrik «Pharmakokinetik»).
Ältere Patienten
Es ist keine Dosisanpassung erforderlich. Für Patienten im Alter von ≥85 Jahren liegen keine Daten vor.
Kinder und Jugendliche
Nerlynx wird nicht bei Kindern und Jugendlichen angewendet.
Ausgelassene Dosis
Verpasste Dosen dürfen nicht nachgeholt werden und die Behandlung muss mit der nächsten planmässigen empfohlenen Tagesdosis fortgesetzt werden.
Art der Anwendung
Nerlynx ist zur oralen Einnahme vorgesehen. Die Tabletten sollten als Ganzes möglichst mit Wasser geschluckt und nicht zerdrückt oder aufgelöst und vorzugsweise morgens zusammen mit Nahrung eingenommen werden (siehe Rubrik «Pharmakokinetik»).
Kontraindikationen·Überempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe
·Gleichzeitige Verabreichung der folgenden Medikamente, bei denen es sich um starke Induktoren von CYP3A4/P-gp-Isoform von Cytochrom P450 handelt, wie zum Beispiel:
·Carbamazepin, Phenytoin (Antiepileptika);
·Johanniskraut (Hypericum perforatum) (pflanzliches Arzneimittel);
·Rifampicin (antimykobakterielles Arzneimittel).
·Schwere Leberinsuffizienz (Child-Pugh-Klasse C)
Warnhinweise und VorsichtsmassnahmenIn der Zulassungsstudie wurden nur solche Patienten behandelt, die eine adjuvante Vorbehandlung mit Trastuzumab und Chemotherapie erhielten. Für die Situation nach anderen neoadjuvanten oder adjuvanten Vortherapien liegen derzeit keine Daten vor.
Durchfall
Durchfall wurde während der Behandlung mit Nerlynx berichtet (siehe Rubriken «Dosierung/Anwendung» und «Unerwünschte Wirkungen»). Es kann sich dabei um schweren Durchfall handeln, der mit Dehydratation einhergeht.
Durchfall tritt gewöhnlich früh während der ersten oder zweiten Woche der Behandlung mit Nerlynx auf und kann wiederholt auftreten.
Patienten sollten angewiesen werden, die prophylaktische Durchfallbehandlung zusammen mit der ersten Nerlynx-Dosis zu beginnen und während der ersten 1–2 Monate der Nerlynx-Behandlung regelmässige Dosen des Durchfallmedikaments einzunehmen, sodass eine Häufigkeit von 1–2 Stuhlgängen pro Tag erreicht wird.
Ältere Patienten
Ältere Patienten (≥65 Jahre) haben ein erhöhtes Risiko für Niereninsuffizienz und Dehydratation, die eine Komplikation von Durchfall sein können, weswegen diese Patienten sorgfältig überwacht werden sollten.
Patienten mit einer signifikanten, chronischen Erkrankung des Gastrointestinaltrakts
Patienten mit einer signifikanten, chronischen Erkrankung des Gastrointestinaltrakts und Durchfall als Hauptsymptom wurden nicht in die Pivotstudie einbezogen und sollten sorgfältig überwacht werden.
Nierenfunktionsstörung
Patienten mit Nierenfunktionsstörung haben ein erhöhtes Risiko für Komplikationen durch Dehydratation, wenn bei ihnen Durchfall auftritt, und sollten daher sorgfältig überwacht werden (siehe Rubrik «Dosierung/Anwendung» und Rubrik «Pharmakokinetische Eigenschaften»).
Leberfunktion
Lebertoxizität wurde bei Patienten berichtet, die mit Nerlynx behandelt wurden. Leberfunktionstests, einschliesslich Überwachung von Alaninaminotransferase (ALT), Aspartataminotransferase (AST) und Gesamtbilirubin, sollten während der Behandlung in Woche 1, in den 3 Folgemonaten monatlich und danach alle 6 Wochen bzw. solange dies klinisch indiziert ist, durchgeführt werden (siehe Rubrik «Dosierung/Anwendung»).
Patienten mit Durchfall Schweregrad ≥3, denen intravenös Flüssigkeit zugeführt werden muss oder die Zeichen bzw. Symptome von Lebertoxizität wie zunehmende Fatigue, Übelkeit, Erbrechen, Gelbsucht, Schmerz oder Druckschmerz im rechten oberen Quadranten, Fieber, Hautausschlag und/oder Eosinophilie aufweisen, müssen hinsichtlich der Änderungen der Leberfunktionstests beurteilt werden. Das fraktionierte Bilirubin und die Prothrombinzeit sollten während der Beurteilung der Lebertoxizität ebenfalls erfasst werden.
Linksventrikuläre Funktion
Linksventrikuläre Dysfunktion wurde mit HER2-Hemmung in Verbindung gebracht. Nerlynx wurde nicht bei Patienten mit einer linksventrikulären Ejektionsfraktion (LVEF) unterhalb des unteren Grenzwerts oder bei Patienten mit einer Anamnese signifikanter Herzerkrankungen untersucht. Bei Patienten mit bekannten Herz-Risikofaktoren sollte, sofern klinisch indiziert, eine Herzüberwachung, einschliesslich der Beurteilung von LVEF, durchgeführt werden.
Protonenpumpen-Inhibitoren (PPIs), H2-Rezeptorantagonisten und Antazida
Behandlungen, die den pH-Wert des Magens erhöhen, können die Resorption von Neratinib vermindern und damit die systemische Exposition verringern. Die gleichzeitige Behandlung mit Protonenpumpen-Inhibitoren (PPIs) wird nicht empfohlen. Im Falle der Anwendung von H2-Rezeptor-Antagonisten oder Antazida sollten die Verabreichungsmodalitäten angepasst werden (siehe Rubriken «Warnhinweise und Vorsichtsmassnahmen», «Interaktionen» und «Pharmakokinetik»).
Schwangerschaft
Neratinib kann bei Verabreichung an schwangere Frauen den Fötus schädigen (siehe Rubrik «Schwangerschaft, Stillzeit»).
Erkrankungen der Haut und des Unterhautzellgewebes
Nerlynx steht in Verbindung mit Erkrankungen der Haut und des Unterhautzellgewebes. Patienten, die Symptome von Erkrankungen der Haut und des Unterhautzellgewebes aufweisen, sollten sorgfältig überwacht werden (siehe Rubrik «Unerwünschte Wirkungen»).
Begleitbehandlungen mit CYP3A4- und P-gp-Hemmern
Begleitbehandlungen mit starken oder moderaten CYP3A4- und P-gp-Hemmern werden aufgrund des Risikos einer erhöhten Neratinib-Exposition nicht empfohlen. Wenn der Hemmer nicht vermieden werden kann, ist eine Anpassung der Nerlynx-Dosierung vorzunehmen (siehe Rubriken «Dosierung/Anwendung», Warnhinweise und Vorsichtsmassnahmen und «Interaktionen»).
Grapefruit- und Granatapfelsaft sollte während der Behandlung mit Nerlynx vermieden werden (siehe Rubriken «Warnhinweise und Vorsichtsmassnahmen» und «Interaktionen»).
Begleitbehandlung mit moderaten Induktoren von CYP3A4 und P-gp
Eine begleitende Behandlung mit moderaten CYP3A4- und P-gp-Induktoren wird nicht empfohlen, da sie zu einer Verminderung der Wirksamkeit von Neratinib führen kann (siehe Rubriken «Interaktionen» und «Pharmakokinetik»).
Begleitbehandlung mit P-gp-Substraten
Patienten, die gleichzeitig mit Wirkstoffen behandelt werden, die ein enges therapeutisches Fenster aufweisen und bei deren Aufnahme gastrointestinale P-gp-Transporter beteiligt sind, sollten sorgfältig überwacht werden (siehe Rubriken «Interaktionen» und «Pharmakokinetik»).
InteraktionenWirkung von Nerlynx auf andere Arzneimittel
Hormonelle Empfängnisverhütungsmittel
Es ist derzeit nicht bekannt, ob Nerlynx die Wirksamkeit systemisch wirkender, hormoneller Empfängnisverhütungsmittel vermindert. Frauen, die systemisch wirkende, hormonelle Empfängnisverhütungsmittel verwenden, sollten daher zusätzlich eine Barrieremethode anwenden (siehe Rubrik «Schwangerschaft, Stillzeit»).
P-Glycoprotein-Efflux-Transporter-Substrate
In-vitro-Studien haben gezeigt, dass Neratinib ein Hemmer von P-Glycoprotein (P-gp-)Transportern ist. Dies wurde durch eine klinische Studie bei gesunden Studienteilnehmern mit Digoxin als Testsubstrat bestätigt, in denen sich eine Steigerung von Cmax um 54% und AUC um 32% bei gleichzeitiger Verabreichung mehrerer oraler Dosen von Neratinib 240 mg im Vergleich zur Exposition bei alleiniger Verabreichung von Digoxin zeigte. Dies könnte klinisch relevant sein für Patienten, die gleichzeitig mit Wirkstoffen behandelt werden, die ein enges therapeutisches Fenster aufweisen und bei deren Aufnahme über den Gastrointestinaltrakt P-gp-Transporter beteiligt sind (z.B. Digoxin, Colchicin, Dabigatran, Phenytoin, Statine, Ciclosporin, Everolimus, Sirolimus, Tacrolimus). Diese Patienten sollten sorgfältig überwacht werden (siehe Rubrik «Warnhinweise und Vorsichtsmassnahmen»).
Substrate des Brustkrebsresistenzproteins
Wie in-vitro-Studien vermuten lassen, hat Neratinib möglicherweise bei 10 µM eine hemmende Wirkung auf das Brustkrebsresistenzprotein (BCRP) im Darm. Eine klinische Studie mit BCRP-Substraten wurde nicht durchgeführt. Da die gleichzeitige Verabreichung von Neratinib mit BCRP-Substraten zu einer erhöhten Exposition gegenüber diesen Substraten führen kann, sollten Patienten, die mit BCRP-Hemmern behandelt werden (z.B. Rosuvastatin, Sulfasalazin und Irinotecan), sorgfältig überwacht werden.
Andere Transporter
Es gab keine klinisch relevante Hemmung der humanen BSEP-Efflux-Transporter-Aktivität in vitro, mit einem berichteten IC50-Wert von > 10 μM.
Neratinib hatte keine hemmende Wirkung in Bezug auf die Aufnahme-Transporter OATP1B1*1a, OATP1B3, OAT1, OAT3 und OCT2, wobei die berichteten IC50-Werte > 10μM betrugen. Neratinib hatte eine hemmende Aktivität in Bezug auf den OCT1-Aufnahme-Transporter, mit einem IC50-Wert von 2,9 μM.
Wirkung von Neratinib auf CYP-Substrate
Neratinib und der Metabolit M6 waren keine potenten direkten Inhibitoren von CYP1A2, 2A6, 2B6, 2C8, 2C9, 2D6 oder 3A4 und eine zeitabhängige Hemmung wird nicht erwartet.
Neratinib wirkte nicht induzierend auf CYP1A2, 2B6, 2C9 oder 3A4.
Wirkung anderer Arzneimittel auf Nerlynx
CYP3A4-/P-gp-Hemmer
Die gleichzeitige Verabreichung einer oralen Einzeldosis von 240 mg Neratinib in Gegenwart von Ketoconazol (400 mg einmal täglich über 5 Tage), einem starken CYP3A4-/P-gp-Inhibitor, erhöhte die systemische Neratinib-Exposition im Vergleich zu allein verabreichtem Neratinib um das 3,2-bzw. 4,8-Fache bezüglich Cmax bzw. AUC.
Modellbasierte Prädiktionsanalysen deuteten darauf hin, dass die gleichzeitige Verabreichung einer oralen Einzeldosis von 240 mg Neratinib mit Fluconazol (200 mg einmal täglich über 8 Tage), einem moderaten CYP3A4-Inhibitor, die systemische Neratinib-Exposition im Vergleich zur alleinigen Neratinib-Verabreichung um das 1,3- bzw. 1,7-Fache bezüglich Cmax bzw. AUC erhöht.
Modellbasierte Prädiktionsanalyen legten nahe, dass die gleichzeitige Verabreichung einer oralen Einzeldosis von 240 mg Neratinib mit Verapamil (120 mg zweimal täglich über 8 Tage), einem moderaten CYP3A4- und starken P-gp-Inhibitor, die systemische Neratinib-Exposition im Vergleich zur alleinigen Neratinib-Verabreichung um das 3,0- bzw. 4,0-Fache bezüglich Cmax bzw. AUC erhöht.
Klinische Studien und modellbasierte Prädiktionsanalysen haben gezeigt, dass die gleichzeitige Anwendung von starken oder moderaten CYP3A4-/P-gp-Hemmern die systemische Neratinib-Exposition signifikant erhöht. Daher wird die gleichzeitige Anwendung von Neratinib mit starken und moderaten CYP3A4-/P-gp-Hemmern nicht empfohlen (z.B. Atazanavir, Indinavir [in der Schweiz nicht zugelassen], Nefazodon [in der Schweiz nicht zugelassen], Nelfinavir [in der Schweiz nicht zugelassen], Ritonavir, Saquinavir, Lopinavir, Ketoconazol [in der Schweiz nicht zugelassen], Itraconazol, Clarithromycin, Troleanomycin, Voriconazol oder Cobicistat; moderate Inhibitoren z.B. Ciprofloxacin, Ciclosporin, Diltiazem, Fluconazol, Erythromycin, Fluvoxamin und Verapamil). Wenn der Hemmer nicht vermieden werden kann, ist eine Dosisanpassung von Nerlynx vorzunehmen.
Grapefruit und Granatapfel oder Grapefruit- und Granatapfelsaft können die Plasmakonzentration von Neratinib ebenfalls erhöhen und sollten vermieden werden (siehe Rubriken «Dosierung/Anwendung» und «Warnhinweise und Vorsichtsmassnahmen»).
Protonenpumpen-Inhibitoren, H2-Rezeptorantagonisten und Antazida
Die Löslichkeit von Neratinib in vitro hängt vom pH-Wert ab.
Die gleichzeitige Verabreichung von Lansoprazol oder Ranitidin (1 x 300 mg) mit einer Einzeldosis von 240 mg Neratinib führte bei gesunden Freiwilligen zu einer um etwa 70 % bzw. 50 % verringerten Neratinib-Exposition. Das Ausmass der Ranitidin-Wechselwirkung in Bezug auf die Neratinib-AUC wurde um etwa 25 % vermindert, indem Ranitidin (2 x 150 mg) 2 Stunden nach Neratinib gestaffelt verabreicht wurde.
Begleitbehandlungen mit Substanzen, die den pH-Wert des Magens erhöhen, werden nicht empfohlen, da dies die Absorption von Neratinib vermindern und dadurch die systemische Exposition verringern kann. Die gleichzeitige Behandlung mit Protonenpumpeninhibitoren (PPIs) (z.B. Omeprazol oder Lansoprazol) wird nicht empfohlen.
Nerlynx sollte mindestens 2 Stunden vor oder 10 Stunden nach der Einnahme des H2-Rezeptor-Antagonisten eingenommen werden. Zwischen der Einnahme von Nerlynx und der Einnahme von Antazida sollten mindestens 3 Stunden liegen (siehe Rubriken «Warnhinweise und Vorsichtsmassnahmen»).
Loperamid als Anti-Diarrhoikum
Klinische Studien zeigten keine klinisch signifikanten Unterschiede in der Exposition von Probanden gegenüber Neratinib mit oder ohne gleichzeitige Verabreichung von Loperamid (siehe Rubrik «Pharmakokinetik»).
CYP3A4-/P-gp-Induktoren
Nach gleichzeitiger Verabreichung von 240 mg Neratinib mit wiederholten Dosen von 600 mg Rifampicin, einem starken CYP3A4-/P-gp-Induktor, zeigte sich eine signifikante Verringerung der Neratinib-Exposition im Vergleich zur alleinigen Neratinib-Verabreichung um 76 % bzw. 87 % bezüglich Cmax bzw. AUC.
Diese Klinische Studie hat gezeigt, dass die gleichzeitige Anwendung von starken CYP3A4-/P-gp-Induktoren die Neratinib-Exposition signifikant vermindert. Daher ist die gleichzeitige Anwendung von Neratinib mit starken CYP3A4-/P-gp-Induktoren kontraindiziert (z.B. Phenytoin, Carbamazepin, Rifampicin oder pflanzliche Präparate, die Johanniskraut [Hypericum perforatum] enthalten) Die gleichzeitige Einnahme von Neratinib mit moderaten CYP3A4/P-gp-Induktoren wird nicht empfohlen, da dies ebenfalls zu einem Verlust der Wirksamkeit von Neratinib führen kann (Beispiele für moderate Induktoren: Bosentan, Efavirenz, Etravirin, Phenobarbital, Primidon, Dexamethason) (siehe Rubriken «Kontraindikation»).
Wirkung anderer Arzneimittel auf Neratinib
Für Neratinib wurden keine offensichtlichen, klinisch relevanten Arzneimittelwechselwirkungen bei gleichzeitiger Verabreichung mit Capecitabin, Paclitaxel, Trastuzumab, Vinorelbin oder Antidiarrhoika (Loperamid) beobachtet (siehe Rubrik «Interaktionen»).
Schwangerschaft, StillzeitFrauen im gebärfähigen Alter/Empfängnisverhütung bei Frauen und Männern
Aufgrund tierexperimentell erhobener Befunde kann Neratinib bei Behandlung schwangerer Frauen den Fötus schädigen. Frauen sollten während der Einnahme von Nerlynx und bis zu 1 Monat nach Behandlungsende nicht schwanger werden. Daher müssen gebärfähige Frauen während der Einnahme von Nerlynx und bis 1 Monat nach Behandlungsende hochwirksame Empfängnisverhütungsmethoden anwenden.
Es ist derzeit nicht bekannt, ob Neratinib die Wirksamkeit systemisch wirkender, hormoneller Kontrazeptiva vermindern kann. Frauen, die systemisch wirkende, hormonelle Kontrazeptiva verwenden, sollten daher zusätzlich eine Barrieremethode anwenden.
Männer sollten während der Behandlung und für 3 Monate nach Behandlungsende eine Barrieremethode zur Empfängnisverhütung verwenden.
Schwangerschaft
Es liegen keine ausreichenden Daten zur Anwendung bei schwangeren Frauen vor.
Tierexperimentelle Studien haben embryonale/fötale Mortalität und morphologische Fehlbildungen beim Fötus gezeigt (siehe Rubrik «Präklinische Daten»).
Das potentielle Risiko für den Menschen ist nicht bekannt.
Während der Schwangerschaft darf das Arzneimittel nicht verabreicht werden, es sei denn der klinische Zustand der Frau erfordert eine Behandlung mit Neratinib.
Falls Neratinib während der Schwangerschaft angewendet wird oder wenn die Patientin während der Behandlung mit Nerlynx schwanger wird, sollte sie über die potenzielle Gefahr für den Fötus informiert werden.
Stillzeit
Es ist nicht bekannt, ob Neratinib in die Muttermilch übergeht. Ein Risiko für den gestillten Säugling kann nicht ausgeschlossen werden. Es muss eine Entscheidung darüber getroffen werden, ob das Stillen beendet oder Nerlynx abgesetzt werden soll. Dabei sind sowohl der Nutzen von Nerlynx für die Mutter als auch die Bedeutung des Stillens für das Kind zu berücksichtigen.
Fertilität
Es wurden keine Studien zur Fertilität bei Frauen und Männern durchgeführt. Bei Ratten wurden keine signifikanten Veränderungen der Fertilitätsparameter festgestellt. Bei Hunden trat mit erhöhter Inzidenz Hodenhypoplasie auf (siehe Rubrik «Präklinische Daten»).
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenNerlynx hat einen geringen bis moderaten Einfluss auf die Fahrtüchtigkeit oder die Fähigkeit, Maschinen zu bedienen.
Fatigue, Schwindelgefühl, Dehydratation und Ohnmacht wurden als Nebenwirkungen von Neratinib berichtet. Der klinische Zustand des Patienten ist zu berücksichtigen bei der Beurteilung seiner Fähigkeit zur Durchführung von Aufgaben, die Urteilsvermögen, motorische oder kognitive Fähigkeiten erfordern.
Unerwünschte WirkungenZusammenfassung des Sicherheitsprofils
Die am häufigsten auftretenden Nebenwirkungen mit beliebigem Schweregrad waren Durchfall (93,6%), Übelkeit (42,5%), Fatigue (27,3%), Erbrechen (26,8%), Bauchschmerzen (22,7%), Hautausschlag (15,4%), Appetitlosigkeit (13,7%), Schmerzen im Oberbauch (13,2%), Stomatitis (11,2%) und Muskelspasmen (10,0%).
Die am häufigsten auftretenden Nebenwirkungen mit Schweregrad 3–4 waren Durchfall (36,9% Schweregrad 3 und 0,2% Schweregrad 4) und Erbrechen (3,4% Schweregrad 3 und 0,1% Schweregrad 4).
Zu den als schwerwiegend berichteten Nebenwirkungen zählten Durchfall (1,9%), Erbrechen (1,3%), Dehydratation (1,1%), Übelkeit (0,5%), erhöhte Alaninaminotransferase (0,4%), erhöhte Aspartataminotransferase (0,4%), Bauchschmerzen (0,3%), Fatigue (0,3%) und Appetitlosigkeit (0,2%).
Tabellarische Auflistung der Nebenwirkungen
In Tabelle 5 sind die für Neratinib beobachteten Nebenwirkungen basierend auf der Beurteilung gepoolter Daten von 1.710 Patienten aufgelistet.
Die MedDRA-Datenbank für die Häufigkeitskonvention und Systemorganklassen wurde zur Klassifizierung der Häufigkeit verwendet:
«sehr häufig» (≥1/10)
«häufig» (≥1/100, <1/10),
«gelegentlich» (≥1/1'000, <1/100)
«selten» (≥1/10'000, <1/1'000)
«sehr selten» (<1/10'000)
«nicht bekannt» (kann aus den verfügbaren Daten nicht abgeschätzt werden)
Innerhalb der einzelnen Häufigkeitsgruppen werden die Nebenwirkungen nach abnehmendem Schweregrad angegeben.
Tabelle 5: Nebenwirkungen aufgrund von Nerlynx in Monotherapie-Brustkrebsstudien
|
Systemorganklasse
|
Häufigkeit
|
Nebenwirkung
| |
Infektionen und parasitäre Erkrankungen
|
Häufig
|
Harnwegsinfektion
| |
Stoffwechsel- und Ernährungsstörungen
|
Sehr häufig
|
Appetitlosigkeit
| |
Häufig
|
Dehydratation
| |
Erkrankungen des Nervensystems
|
Häufig
|
Synkope
| |
Erkrankungen der Atemwege, des Brustraums und Mediastinums
|
Häufig
|
Epistaxis
| |
Erkrankungen des Gastrointestinaltrakts
|
Sehr häufig
|
Durchfall, Erbrechen, Übelkeit, Bauchschmerzen, Schmerzen im Oberbauch und Stomatitis1
| |
Häufig
|
Völlegefühl, trockener Mund und Dyspepsie
| |
Leber- und Gallenerkrankungen
|
Häufig
|
erhöhte Alaninaminotransferase, erhöhte Aspartataminotransferase
| |
Gelegentlich
|
erhöhte Bilirubinkonzentration im Blut
| |
Erkrankungen der Haut und des Unterhautzellgewebes
|
Sehr häufig
|
Hautausschlag2
| |
Häufig
|
Nagelerkrankungen3, rissige und trockene Haut
| |
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
|
Sehr häufig
|
Muskelspasmen
| |
Erkrankungen der Nieren und Harnwege
|
Häufig
|
erhöhte Kreatinin-Werte im Blut
| |
Gelegentlich
|
Nierenfunktionsstörung
| |
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
|
Sehr häufig
|
Fatigue
| |
Untersuchungen
|
Häufig
|
Gewichtsabnahme
| |
1
U. a. Stomatitis, Stomatitis aphtosa, Mundgeschwür, Blasenbildung an der Mundschleimhaut und Schleimhautentzündung.
2 U. a. Hautausschlag, erythematöser Hautausschlag, follikulärer Hautausschlag, generalisierter Hautausschlag, Hautausschlag mit Juckreiz und pustulöser Hautausschlag.
3 U. a. Nagelerkrankungen, Nagelinfektion, brüchige Fingernägel und Verfärbung der Fingernägel.
|
Beschreibung spezifischer unerwünschter Wirkungen und Zusatzinformationen
Durchfall
Von den 1660 mit Nerlynx-Monotherapie und ohne Loperamid-Prophylaxe behandelten Patienten erlitten 94,6% mindestens 1 Durchfallepisode. Durchfall mit Schweregrad 3 wurde bei 37,5% der Nerlynx-Patienten berichtet. 0,2% der Patienten hatten als Schweregrad 4 klassifizierten Durchfall. Durchfall führte bei 1,9% der mit Nerlynx behandelten Patienten zu einer Krankenhauseinweisung.
Durchfall trat im Allgemeinen im ersten Monat auf, wobei 83,6% der Patienten diese Nebenwirkung in der ersten Woche, 46,9% in der zweiten Woche, 40,2% in der dritten Woche und 43,2% in der vierten Woche berichteten (der Median für den Zeitpunkt des ersten Auftretens lag bei 2 Tagen).
Der Median für die Dauer einer einzelnen Durchfallepisode eines beliebigen Schweregrads lag bei 2 Tagen. Der Median für die kumulierte Dauer von Durchfall eines beliebigen Schweregrads lag bei 59 Tagen und der Median für die kumulierte Dauer von Durchfall mit Schweregrad 3 lag bei 5 Tagen.
Durchfall war zudem die Nebenwirkung, die am häufigsten zum Absetzen des Arzneimittels führte: 14,4% der mit Nerlynx und ohne Loperamid-Prophylaxe behandelten Patienten setzten die Behandlung aufgrund von Durchfall ab. Dosisreduktionen wurden bei 24,7% der mit Nerlynx behandelten Patienten vorgenommen.
Hautausschlag
In der Nerlynx-Monotherapiegruppe erlitten 16,7% der Patienten einen Ausschlag. Die Inzidenz von Schweregrad 1 und Schweregrad 2 lag bei 13,3% bzw. 2,9%. 0,4% der mit Nerlynx behandelten Patienten erlitten einen Ausschlag mit Schweregrad 3.
Nagelerkrankungen
In der Nerlynx-Monotherapiegruppe erlitten 7,8% der Patienten Nagelerkrankungen. Die Inzidenz von Schweregrad 1 und Schweregrad 2 lag bei 6,2% bzw. 1,4%. 0,2% der mit Nerlynx behandelten Patienten erlitten eine Nagelerkrankung mit Schweregrad 3.
Sowohl Ausschlag als auch Nagelerkrankungen führten bei 0,6% der mit Nerlynx behandelten Patienten zu einem Abbruch der Behandlung.
Lebertoxizität
Leber-bezogene Nebenwirkungen wurden in der Phase-III-Pivotstudie ExteNET (3004) häufiger im Nerlynx- als im Placebo-Studienarm berichtet (12,4% bzw. 6,6%), was hauptsächlich auf erhöhte Alaninaminotransferase (ALT) (8,5% bzw. 3,2%), erhöhte Aspartataminotransferase (AST) (7,4 bzw. 3,3%) und erhöhte alkalische Phosphatase im Blut (2,1% bzw. 1,1%) zurückzuführen war. Nebenwirkungen vom Schweregrad 3 wurden bei 1,6% bzw. 0,5% und Nebenwirkungen vom Schweregrad 4 wurden bei 0,2% bzw. 0,1% der mit Nerlynx bzw. Placebo behandelten Patienten berichtet. Erhöhte ALT vom Schweregrad 3 wurde bei 1,1% bzw. 0,2% und erhöhte ALT vom Schweregrad 4 wurde bei 0,2% bzw. 0,0% der mit Nerlynx bzw. Placebo behandelten Patienten berichtet. Erhöhte AST vom Schweregrad 3 wurde bei 0,5% bzw. 0,3% und erhöhte AST vom Schweregrad 4 wurde bei 0,2% bzw. 0,0% der mit Nerlynx bzw. Placebo behandelten Patienten berichtet. Es gab keine Nebenwirkungen vom Schweregrad 3 oder 4 in Verbindung mit erhöhter Bilirubinkonzentration im Blut.
Spezialpopulationen
Ältere Patienten
In der Phase-III-Pivotstudie ExteNET (3004) betrug das Durchschnittsalter 52 Jahre im Nerlynx-Studienarm. 1.236 Patienten waren <65 Jahre alt, 172 waren ≥65 Jahre alt, von ihnen hatten 25 ein Alter von 75 Jahren oder mehr.
In der Altersgruppe mit ≥65 Jahren kam es häufiger zu einem Behandlungsabbruch aufgrund von Nebenwirkungen als in der Altersgruppe mit <65 Jahren. Im Nerlynx-Studienarm lagen die jeweiligen Anteile bei 44,8% bzw. 25,2%.
Die Inzidenz schwerwiegender Nebenwirkungen betrug im Nerlynx-Studienarm gegenüber dem Placebo-Studienarm 7,0% gegenüber 5,7% (<65 Jahre alt) und 9,9% gegenüber 8,1% (≥65 Jahre alt). Die in der Altersgruppe mit ≥65 Jahren am häufigsten berichteten Nebenwirkungen waren Erbrechen (2,3%), Durchfall (1,7%), Dehydratation (1,2%) und Niereninsuffizienz (1,2%).
Der Anteil an behandlungsbedingten Nebenwirkungen, die zu einer Krankenhauseinweisung führten, betrug im Nerlynx-Studienarm im Vergleich zum Placebo-Studienarm 6,3% gegenüber 4,9% in der Altersgruppe mit <65 Jahren und 8,7% gegenüber 8,1% in der Altersgruppe mit ≥65 Jahren.
Ethnische Gruppen
In der Phase-III-Pivotstudie ExteNET (3004) war die Häufigkeit unter Behandlung auftretender unerwünschter Ereignisse (TEAEs) in der Systemorganklasse (SOC) Erkrankungen der Haut und des Unterhautzellgewebes bei mit Nerlynx behandelten asiatischen Patienten höher als bei kaukasischen Patienten (56,4% bzw. 34,5%), während sie bei Placebo-Patienten vergleichbar war (24,9% bzw. 22,8%). Gepoolte Sicherheitsdaten von 1.710 mit Nerlynx-Monotherapie behandelten Patienten zeigten eine höhere Inzidenz dermatologischer Toxizitäten bei asiatischen Patienten (57,1%) gegenüber kaukasischen Patienten (34,6%).
Die Analyse der gepoolten Sicherheitsdaten ergab, dass die Mehrheit der TEAEs in der SOC für Erkrankungen der Haut und des Unterhautzellgewebes bei Asiaten vom Schweregrad 1 (43,3%) und Schweregrad 2 (12,3%) war. Bei kaukasischen Patienten betrug die Inzidenz von Ereignissen mit Schweregrad 1 und Schweregrad 2 25,6% bzw. 7,8%. Die Häufigkeit von Ereignissen des Schweregrades 3 war bei asiatischen und kaukasischen Patienten ähnlich (1,6% bzw. 1,0%). Es gab keinen Unterschied in der Häufigkeit von schwerwiegenden unerwünschten Ereignissen (SUEs) in der SOC für Erkrankungen der Haut und des Unterhautzellgewebes zwischen den asiatischen und kaukasischen Untergruppen. Die häufigsten TEAEs in der SOC für Erkrankungen der Haut und des Unterhautzellgewebes, welche häufiger bei asiatischen Patienten als bei kaukasischen Patienten auftraten, waren Ausschlag (29,4% bzw. 13,5%), palmar-plantare Erythrodysästhesie (9,9% bzw. 1,0%) und akneiforme Dermatitis (6,0% bzw. 1,0%).
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungIm Falle einer Überdosis sollten die Verabreichung ausgesetzt und unterstützende Massnahmen eingeleitet werden.
Anzeichen und Symptome
Im Rahmen der klinischen Studien waren die am häufigsten mit einer Überdosis einhergehenden Nebenwirkungen Durchfall mit oder ohne Übelkeit, Erbrechen und Dehydratation.
In einer Dosiseskalationsstudie wurden gesunden Studienteilnehmern Nerlynx-Einzeldosen von bis zu 800 mg oral verabreicht. Die Häufigkeit und der Schweregrad der Erkrankungen des Gastrointestinaltrakts (Durchfall, Bauchschmerzen, Übelkeit und Erbrechen) schienen dosisabhängig zu sein. Nerlynx-Einzeldosen über 800 mg wurden in den klinischen Studien nicht verabreicht.
Behandlung
Es gibt kein spezifisches Gegenmittel, und der Nutzen von Hämodialyse zur Behandlung einer Nerlynx-Überdosis ist unbekannt.
Eigenschaften/WirkungenATC-Code
L01EH02
Wirkungsmechanismus
Neratinib bindet an den HER2-Rezeptor, verringert die EGFR- und HER2-Autophosphorylierung der nachgelagerten MAPK- und AKT-Signalpfade und hemmt wirksam die Tumorzellproliferation in vitro. Neratinib hemmte EGFR- und/oder HER2-exprimierende Karzinomzelllinien mit einer zellulären IC50 <100 nM.
Pharmakodynamik
Neratinib ist ein irreversibler Tyrosinkinasehemmer (TKI) des viralen Onkogen-Homologs der Erythroblastenleukämie (ERBB), der die Signaltransduktion des mitogenen Wachstumsfaktors durch kovalente Bindung mit hoher Affinität an der ATP-Bindungsstelle von 3 epidermalen Wachstumsfaktorrezeptoren (EGFRs) blockiert: EGFR (codiert als ERBB1), HER2 (codiert als ERBB2) und HER4 (codiert als ERBB4) oder ihre aktiven Heterodimere mit HER3 (codiert als ERBB3). Dadurch wird eine nachhaltige Hemmung dieser wachstumsfördernden Pfade bei Brustkrebs mit HER2-Amplifizierung oder -Überexpression oder HER2-Mutation erreicht.
Klinische Wirksamkeit
In der multizentrischen, randomisierten, doppelblinden, placebokontrollierten Phase-III-Pivotstudie ExteNET (3004) wurden 2.840 Frauen mit HER2-positivem Brustkrebs (lokal bestätigt durch Laboruntersuchung) im Frühstadium, die eine adjuvante Behandlung mit Trastuzumab und eine Chemotherapie abgeschlossen hatten, 1:1 randomisiert und erhielten ein Jahr lang täglich entweder Nerlynx oder ein Placebo. Das mediane Alter in der zu behandelnden (ITT) Population betrug 52 Jahre (59,9% waren ≥50 Jahre alt, 12,3% waren ≥65 Jahre alt); 81,0% waren kaukasische Patientinnen, 2,6% waren schwarze oder afroamerikanische Patientinnen, 13,6% waren asiatische Patientinnen und 2,9% wiesen eine sonstige ethnische Zugehörigkeit auf. Zum Baseline-Zeitpunkt hatten 57,4% eine Hormonrezeptor-positive Erkrankung (definiert als ER-positiv und/oder PgR-positiv), 23,6% wiesen keine Lymphknotenmetastasen auf, 46,8% hatten einen bis drei positive Lymphknoten und 29,6% hatten vier oder mehr positive Lymphknoten. Etwa 10% der Patientinnen hatten Stadium-I-Tumore, etwa 40% hatten Stadium-II-Tumore und etwa 30% hatten Stadium-III-Tumore. Der Median für den Zeitraum von der letzten adjuvanten Trastuzumab-Behandlung bis zur Randomisierung lag bei 4,5 Monaten.
Der primäre Wirksamkeitsendpunkt der Studie war das Überleben frei von invasiver Erkrankung (invasive disease-free survival, iDFS). Die sekundären Wirksamkeitsendpunkte der Studie umfassten das krankheitsfreie Überleben (disease-free survival, DFS), einschliesslich duktalem Karzinom in situ (DFS-DCIS), die Zeit bis zum Auftreten von Fernmetastasen (time to distant recurrence, TTDR), das Überleben frei von Fernmetastasen (distant disease-free survival, DDFS), die kumulative Inzidenz von Rezidiven im Zentralnervensystem und das Gesamtüberleben (overall survival, OS).
Die primäre Analyse der Studie 2 Jahre nach der Randomisierung zeigte, dass Nerlynx in der ITT-Population das Risiko für Wiederauftreten einer invasiven Erkrankung oder Tod um 34% (RR = 0,66 mit 95-%-KI (0,49, 0,90), zweiseitiges p = 0,008) verringerte.
Tabelle 6: Primäre Wirksamkeitsanalysen – ITT- und Hormonrezeptor-positive Populationen, bei denen der Abschluss der Trastuzumab- und Chemotherapie weniger als ein Jahr zurücklag
|
Variable
|
Geschätzte Raten für 2-jährige Ereignisfreiheit1
(%)
|
Relatives Risiko
(95-%-KI)2
|
p-Wert3
| |
|
ITT-Population
| |
|
Nerlynx
(N = 1.420)
|
Placebo
(N = 1.420)
|
|
| |
Überleben ohne invasive Erkrankung
|
94,2
|
91,9
|
0,66
(0,49; 0,90)
|
0,008
| |
Krankheitsfreies Überleben, einschliesslich duktales In-situ-Karzinom
|
94,2
|
91,3
|
0,61
(0,45; 0,83)
|
0,001
| |
Überleben ohne Fernmetastasen
|
95,3
|
94,0
|
0,74
(0,52; 1,05)
|
0,094
| |
Zeit bis zum Auftreten von Fernmetastasen
|
95,5
|
94,2
|
0,73
(0,51; 1,04)
|
0,087
| |
ZNS-Rezidiv
|
0,92
|
1,16
|
–
|
0,548
| |
|
Hormonrezeptor-positive Population, bei der der Abschluss der Trastuzumab-Therapie weniger als ein Jahr zurücklag
| |
|
Nerlynx
(N = 670)
|
Placebo
(N = 664)
|
Relatives Risiko
(95-%-KI)4
|
p-Wert5
| |
Überleben ohne invasive Erkrankung
|
95,3
|
90,8
|
0,49
(0,30; 0,78)
|
0,002
| |
Krankheitsfreies Überleben, einschliesslich duktales In-situ-Karzinom
|
95,3
|
90,0
|
0,45
(0,28; 0,71)
|
<0,001
| |
Überleben ohne Fernmetastasen
|
96,1
|
92,9
|
0,53
(0,31; 0,88)
|
0,015
| |
Zeit bis zum Auftreten von Fernmetastasen
|
96,3
|
93,3
|
0,53
(0,30; 0,89)
|
0,017
| |
ZNS-Rezidiv
|
0,34
|
1,01
|
–
|
0,187
|
ZNS = Zentralnervensystem
1 Ereignisfreie Raten für alle Endpunkte mit Ausnahme von ZNS-Rezidiven, da in diesem Fall die kumulative Inzidenz berichtet wird.
2 Stratifiziertes proportionales Hazard-Modell nach Cox.
3 Stratifizierter, zweiseitiger Log-Rank-Test für alle Endpunkte mit Ausnahme von ZNS-Rezidiven, da in diesem Fall die Gray-Methode verwendet wurde.
4 Nicht stratifiziertes proportionales Hazard-Modell nach Cox.
5 Nicht stratifizierter, zweiseitiger Log-Rank-Test für alle Endpunkte mit Ausnahme von ZNS-Rezidiven, da in diesem Fall die Gray-Methode verwendet wurde.
Abbildung 1: Kaplan-Meier-Grafik für krankheitsfreies Überleben – Hormonrezeptor-positive Population, bei der der Abschluss der Trastuzumab- und Chemotherapie weniger als ein Jahr zurücklag
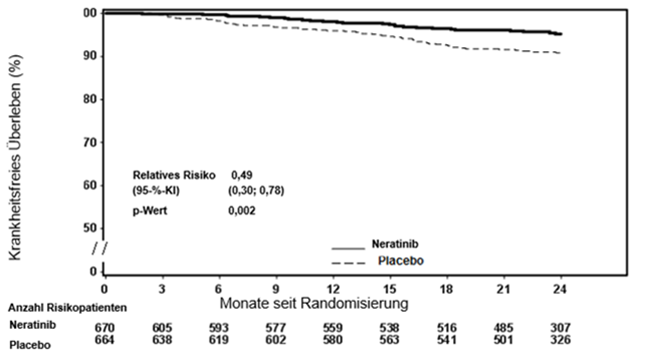
Etwa 75% der Patienten willigten in eine über 24 Monate hinausgehende Nachuntersuchung ein. Beobachtungen mit fehlenden Daten wurden zum Datum der letzten Untersuchung zensiert. Der Nutzen der Behandlung mit Nerlynx gegenüber Placebo blieb nach fünf Jahren bestehen, die Effektgrösse kann jedoch nicht zuverlässig abgeschätzt werden.
Bei Hormonrezeptor-negativen Patienten betrug das relative Risiko für iDFS nach 2 Jahren unabhängig von der Zeit seit der Trastuzumab-Therapie 0,93 mit einem 95-%-KI von 0,60 bis 1,43. In dieser Population wurde die Wirksamkeit nicht nachgewiesen.
An der Pivotstudie 3004 haben ausschliesslich Patientinnen teilgenommen, die zuvor mit Trastuzumab und Chemotherapie behandelt wurden.
Der relative Nutzen der Behandlung mit Nerlynx für hormonrezeptor-positive Patienten innerhalb von im Voraus festgelegten Patientenuntergruppen wird in Abbildung 2 dargestellt.
Bei der Betrachtung der nachstehenden Grafiken ist das absolute Rezidivrisiko zu berücksichtigen, wenn das Risiko/Nutzen-Verhältnis und somit der Nutzen einer Nerlynx-Therapie für die jeweilige Patienten-Untergruppe beurteilt wird. Bei diesen Analysen nach Patienten-Untergruppen ist die Anzahl der Rezidivereignisse in der jeweiligen Untergruppe zu beachten, nicht nur die relative Reduktion des Rezidivrisikos, um den Nutzen zu beurteilen, den die Patienten aus einer Behandlung mit Nerlynx ziehen könnten.
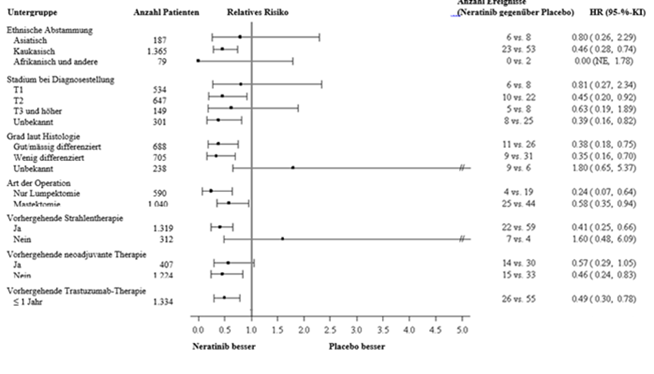
Abbildung 2: Hormonrezeptor-positive Patienten, krankheitsfreies Überleben nach Patientenuntergruppe
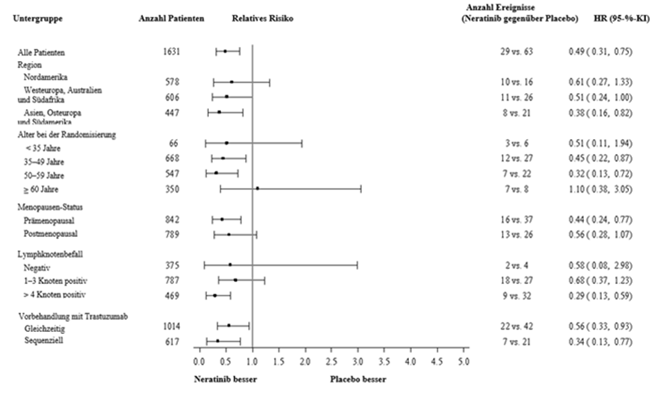
Abbildung 3: Hormonrezeptor-positive Patientinnen, krankheitsfreies Überleben nach Patientenuntergruppe (weitere Untergruppen
Bei einem medianen Follow-up von 8,06 Jahren gab es in der ITT-Population keinen statistisch signifikanten Unterschied im OS zwischen dem Nerlynx- und dem Placebo-Arm [HR 0,96 (95% CI: 0,75, 1,22)].
Ein den Nerlynx-Arm begünstigender Trend wurde in der hormonrezeptor-positiven Population beobachtet, bei denen der Abschluss der Trastuzumab-Therapie weniger als ein Jahr zurücklag [HR 0,79 (95% KI, 0,55, 1,13)].
PharmakokinetikAbsorption
Die Absorption nach der oralen Verabreichung von 240 mg war langsam und die Peak-Plasmakonzentrationen von Neratinib traten etwa 7 Stunden nach der Verabreichung auf. Eine mit Nahrung eingenommene Einzeldosis von 240 mg Neratinib steigerte Cmax und AUC um etwa 17% bzw. 13% im Vergleich zur Verabreichung auf nüchternen Magen. Eine mit einer stark fetthaltigen Mahlzeit eingenommene orale Einzeldosis von 240 mg Neratinib steigerte sowohl Cmax als auch AUC um etwa 100%. In einer Massenbilanz-Studie zeigt die Gesamtrückgewinnung (Urin- und Stuhlausscheidung) von intaktem Neratinib und seinen Metaboliten, dass die resorbierte Neratinib-Fraktion mindestens 10 % und wahrscheinlich mehr als 20 % beträgt. Darüber hinaus legen modellbasierte Prädiktionsanalysen eine resorbierte Gesamtfraktion aus dem Darm (fa) von 26 % nahe.
Die Löslichkeit von Neratinib in vitro ist pH-abhängig. Behandlungen, die den pH-Wert des Magens erhöhen, können die Resorption von Neratinib vermindern und damit die systemische Exposition verringern.
Distribution
Die Bindung von Neratinib an humane Plasmaproteine, einschliesslich der kovalenten Bindung an humanes Serumalbumin (HSA), war grösser als 98% und unabhängig von der Konzentration. Neratinib bindethauptsächlich an HSA und humanes alpha-1-Säure-Glykoprotein (α1AGP). Die Bindung des Hauptmetaboliten M6 an menschliche Plasmaproteine betrug mehr als 99% und war unabhängig von den getesteten M6-Konzentrationen. In-vitro-Studien haben gezeigt, dass Neratinib ein Substrat für P-Glykoprotein (P-gp) und BCRP ist. In-vitro-Studien zeigten, dass Neratinib und sein Hauptmetabolit M6 bei klinisch relevanten Konzentrationen keine Substrate der hepatischen Aufnahmetransporter OATP1B1*1a und OATP1B3 darstellen.
Metabolismus
Neratinib wird hauptsächlich durch CYP3A4 und in geringerem Umfang durch flavinhaltige Monooxygenase (FMO) verstoffwechselt.
Ein vorläufiges Metaboliten-Profiling in humanem Plasma deutet darauf hin, dass Neratinib nach der oralen Verabreichung oxidativ mittels CYP3A4 verstoffwechselt wird. Als zirkulierende Neratinib-Metabolite sind u.a. Pyridin-N-Oxid (M3), N-Dimethyl-Neratinib (M6), Neratinib-Dimethylamin-N-Oxid (M7) und Spuren von Hydroxyl-Neratinib-N-Oxid und Neratinib-bis-N-Oxid (M11) vorhanden. Neratinib ist bei gesunden Studienteilnehmern die vorwiegende Komponente im Plasma, und keiner der zirkulierenden Metabolite (M3, M6, M7 und M11) liegt nach oraler Verabreichung von Neratinib bei über 8% der Gesamtexposition an Neratinib plus Metaboliten. Es wurde gezeigt, dass die Neratinib-Metaboliten M3, M6, M7 und M11 ähnliche Potenzen wie Neratinib in In-vitro-Enzym-(Bindungs-)Assays oder zellbasierten Assays gegenüber Zellen haben, die ERBB1, ERBB2 (HER2) und ERBB4 exprimieren.
Gemäss der Expositionen im Steady-State (AUC) ist Neratinib hauptsächlich für die pharmakologische Aktivität verantwortlich (73%), wobei 20% durch die M6-Exposition und 6% durch M3 zustande kommen und der Beitrag von M7 und M11 vernachlässigbar ist (<1%).
Elimination
Nach einer Einzeldosis von Neratinib betrug die mittlere scheinbare Halbwertzeit von Neratinib im Plasma von Patienten 17 Stunden.
Neratinib wird hauptsächlich über den Stuhlgang ausgeschieden
Nach der oralen Verabreichung einer radioaktiv markierten Einzeldosis von 240 mg Neratinib-Lösung wurden 95,5 % bzw. 0,96 % der verabreichten Dosis im Stuhl bzw. Urin nachgewiesen. Die Exkretion war schnell und vollständig, wobei der grösste Teil der Dosis innerhalb von 48 Stunden im Stuhl und 96,5 % der gesamten Radioaktivität nach 8 Tagen in den Ausscheidungen wiedergefunden wurde.
Neratinib in unveränderter Form war die am häufigsten in den Ausscheidungen vorkommende Substanz und machte 62,1 % der gesamten in den Ausscheidungen wiedergefundenen Dosis aus. Die häufigsten Metabolite im Stuhl waren M6 (19,7 % der verabreichten Dosis), gefolgt von M2, M3 und M7; alle unter 10 % der verabreichten Dosis.
Leberfunktionsstörungen
Neratinib wird hauptsächlich in der Leber verstoffwechselt. Bei Patienten mit schwerer, vorbestehender Leberfunktionsstörung (Child-Pugh-Klasse C) ohne Krebs war die Clearance von Neratinib um 36% verringert und die Exposition gegenüber Neratinib um das etwa 3-Fache erhöht im Vergleich zu gesunden Studienteilnehmern.
Nierenfunktionsstörungen
Es wurden keine pharmakokinetischen Studien bei Patienten mit Nierenfunktionsstörung oder Dialysepatienten durchgeführt. Das populationspharmakokinetische Modell zeigte, dass die Kreatinin-Clearance nicht die Variabilität zwischen Patienten erklärt, weswegen keine Anpassungen der Dosis für Patienten mit leichter bis mittelschwerer Nierenfunktionsstörung empfohlen werden.
Kinder und Jugendliche
Es wurden keine pharmakokinetischen Studien bei Kindern und Jugendlichen durchgeführt.
Präklinische DatenToxizität bei wiederholter Verabreichung
In Studien zur Langzeittoxizität bei Ratten und Hunden waren die Zielorgane der Gastrointestinaltrakt, die Leber und die Haut. Beim Hund lag die NOAEL-Plasmaexposition unterhalb der klinischen Exposition.
Mutagenität
Neratinib war in der Standardreihe der Genotoxizitätsstudien weder klastogen noch mutagen.
Die Neratinib-Metabolite M3, M6, M7 und M11 waren negativ in der Standardreihe der In-vitro-Genotoxizitätsstudien.
Karzinogenität
Eine 6-monatige Studie zur Karzinogenität bei transgenen Tg.rasH2-Mäusen und die 2-Jahres-Daten von Ratten zeigten keine Anzeichen für ein karzinogenes Potenzial.
Reproduktionstoxizität
Bei männlichen und weiblichen Ratten wurden nach Verabreichung von bis zu 12 mg/kg/Tag (einer 29-fach höheren Plasmaexposition als bei klinischer Exposition) keine signifikanten Veränderungen der Fertilitätsparameter festgestellt. In Studien zur Langzeittoxizität bei Hunden wurde eine erhöhte Inzidenz von Hodenhypoplasien bei einer Plasmaexposition beobachtet, die das 0,8-Fache der klinischen Exposition betrug.
Bei Kaninchen wurden unter Dosierungen, die als klinisch relevant gelten, embryonale/fötale Mortalität und morphologische Fehlbildungen beim Fötus (z.B. gewölbter Kopf, Dilatation der Gehirnventrikel, Defekt des ventrikulären Septums, Verformungen der anterioren Fontanellen und erweiterte anteriore und/oder posteriore Fontanellen) festgestellt.
Sonstige HinweiseInkompatibilitäten
Nicht zutreffend.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Haltbarkeit nach Anbruch
Die Flasche ist innerhalb von 2 Monaten nach Anbruch aufzubrauchen.
Besondere Lagerungshinweise
Bei Raumtemperatur (15-25°C) lagern.
Den Behälter im Umkarton aufbewahren, um den Inhalt vor Feuchtigkeit zu schützen.
Ausser Reichweite von Kindern aufbewahren.
Hinweise für die Handhabung
Nicht das Trockenmittel schlucken.
Zulassungsnummer67293 (Swissmedic).
PackungenFlasche mit 180 Filmtabletten mit kindergesichertem Verschluss und innerer Folienversiegelung. (A)
Ein HDPE-Trockenmittelbehälter mit 1 g Kieselsäuregel ist zusammen mit den Tabletten in jeder Flasche enthalten.
ZulassungsinhaberinPierre Fabre Pharma AG, Basel
Stand der InformationDezember 2024
|



