ZusammensetzungWirkstoffe
Olodaterolum (ut Olodateroli hydrochloridum) und Tiotropium (ut Tiotropii bromidum monohydricum).
Hilfsstoffe
Benzalkonii chloridi solutio corresp. Benzalkonii chloridum 1.1 µg, dinatrii edetas, acidum hydrochloridum, aqua purificata, nitrogenium.
Indikationen/AnwendungsmöglichkeitenSpiolto Respimat ist für die bronchienerweiternde Erhaltungstherapie von symptomatischen Patienten mit COPD indiziert, bei welchen eine tief dosierte LAMA oder LABA-Monobehandlung allein nicht genügend ist.
Dosierung/AnwendungDie empfohlene Dosis für Erwachsene beträgt 5 Mikrogramm Olodaterol und 5 Mikrogramm Tiotropium. Dies entspricht zwei Sprühstössen aus dem Respimat-Inhalator, die einmal täglich jeweils zur gleichen Tageszeit verabreicht werden.
Die empfohlene Dosis darf nicht überschritten werden.
Patienten mit Leberfunktionsstörungen
Spiolto Respimat enthält Olodaterol, das überwiegend in der Leber metabolisiert wird.
Patienten mit leichter bis mittelgradiger Leberfunktionsstörung können Spiolto Respimat in der empfohlenen Dosis anwenden. Zur Anwendung von Olodaterol bei Patienten mit schwerer Leberfunktionsstörung liegen keine Daten vor.
Patienten mit Nierenfunktionsstörungen
Patienten mit Nierenfunktionsstörung können Spiolto Respimat in der empfohlenen Dosis anwenden.
Spiolto Respimat enthält Tiotropium, das vorwiegend renal ausgeschieden wird. Daher sollte die Anwendung von Spiolto Respimat bei Patienten mit mittelgradiger bis schwerer Nierenfunktionsstörung engmaschig überwacht werden.
Ältere Patienten
Ältere Patienten können Spiolto Respimat in der empfohlenen Dosierung anwenden.
Kinder und Jugendliche
Es gibt keinen relevanten Nutzen von Spiolto Respimat als COPD-Therapie bei Kindern und Jugendlichen unter 18 Jahren. Die Sicherheit und Wirksamkeit von Spiolto Respimat bei Kindern und Jugendlichen ist nicht erwiesen.
KontraindikationenDie Anwendung von Spiolto Respimat ist bei Patienten mit Überempfindlichkeit gegen Olodaterol oder Tiotropium sowie einen der sonstigen Bestandteile des Arzneimittels kontraindiziert.
Spiolto Respimat ist auch kontraindiziert bei Patienten mit anamnestisch bekannter Überempfindlichkeit gegen Atropin oder eines seiner Derivate, z.B. Ipratropium oder Oxitropium.
Warnhinweise und VorsichtsmassnahmenSpiolto Respimat enthält Benzalkoniumchlorid, dieser Bestandteil kann keuchende Atmung und Atemschwierigkeiten (Bronchospasmen - krampfartige Verengungen der Atemwege) hervorrufen, insbesondere, wenn Sie an Asthma leiden.
Asthma
Bei Asthma darf Spiolto Respimat nicht angewendet werden. Die Wirksamkeit und Sicherheit von Olodaterol und Tiotropium bei Asthma wurde bisher nicht untersucht.
Akuter Bronchospasmus
Spiolto Respimat darf nicht als Notfallmedikation zur Behandlung akuter Bronchospasmen eingesetzt werden.
Überempfindlichkeit
Nach Anwendung von Spiolto Respimat sind allergische Reaktionen vom Soforttyp möglich.
Paradoxer Bronchospasmus
Wie andere Inhalativa kann auch Spiolto Respimat paradoxe Bronchospasmen auslösen, die lebensbedrohend sein können. Sollte ein paradoxer Bronchospasmus auftreten, muss Spiolto Respimat sofort abgesetzt und durch eine alternative Therapie ersetzt werden.
Engwinkelglaukom, Prostatahyperplasie, Blasenhalsobstruktion
Entsprechend der anticholinergen Eigenschaften von Tiotropium muss Spiolto Respimat bei Patienten mit Engwinkelglaukom, Prostatahyperplasie oder Blasenhalsobstruktion mit Vorsicht angewendet werden.
Eingeschränkte Nierenfunktion
Da Tiotropium vorwiegend renal ausgeschieden wird, ist die Anwendung von Spiolto Respimat bei Patienten mit mittelgradiger bis schwerer Nierenfunktionsstörung (Kreatinin-Clearance ≤50 ml/min) engmaschig zu überwachen (siehe Abschnitt «Dosierung/Anwendung»).
Augensymptome
Die Patienten sind im korrekten Gebrauch des Spiolto Respimat zu schulen. Die Lösung oder die Sprühwolke darf nicht in die Augen gelangen. Augenschmerzen oder Augenbeschwerden, Verschwommensehen, visuelle Halos oder verändertes Farbempfinden, verbunden mit geröteten Augen durch Bindehautinjektion und Hornhautödem, können Anzeichen eines Engwinkelglaukoms sein. Beim Auftreten der genannten Symptome in jeglicher Kombination muss unverzüglich ein Augenarzt aufgesucht werden.
Miotische Augentropfen werden nicht als wirksame Behandlung erachtet.
Systemische Wirkungen
Spiolto Respimat enthält einen langwirksamen Beta2-Adrenozeptor-Agonisten. Langwirksame Beta2-Adrenozeptor-Agonisten dürfen bei Patienten mit kardiovaskulären Erkrankungen, insbesondere Koronarinsuffizienz, Herzrhythmusstörungen, hypertroph-obstruktive Kardiomyopathie und Hypertonie, bei Patienten mit Krampfleiden oder Hyperthyreose, bei Patienten mit bekannter oder vermuteter Verlängerung des QT-Intervalls sowie bei Patienten, die ungewöhnlich empfindlich auf sympathomimetische Amine ansprechen, nur mit Vorsicht angewendet werden.
Kardiovaskuläre Wirkungen
Wie andere Beta2-Adrenozeptor-Agonisten kann Olodaterol bei manchen Patienten klinisch relevante kardiovaskuläre Wirkungen zeigen, die sich in einem Anstieg der Pulsfrequenz, des Blutdrucks und/oder anderen Symptomen äussern. Sollten derartige Wirkungen auftreten, muss die Behandlung möglicherweise abgebrochen werden. Darüber hinaus wurden unter der Behandlung mit Beta-Adrenozeptor-Agonisten EKG-Veränderungen beobachtet, z.B. Abflachung der T-Welle und Senkung der ST-Strecke. Die klinische Relevanz dieser Beobachtung ist jedoch nicht bekannt.
Vor der Verschreibung einer Dauerbehandlung mit einem Betaagonisten wie Spiolto Respimat sollten COPD-Patienten hinsichtlich kardiovaskulärer Begleiterkrankungen abgeklärt werden. Dabei empfiehlt sich auch die Durchführung einer EKG-Untersuchung mit Frage nach QTc-Verlängerung.
In klinischen Studien wurde Patienten mit Myokardinfarkt oder Hospitalisation wegen Herzinsuffizienz im letzten Jahr vor Behandlungsbeginn ausgeschlossen.
Hypokaliämie
Beta2-Adrenozeptor-Agonisten können bei manchen Patienten eine erhebliche Hypokaliämie auslösen, die zu unerwünschten kardiovaskulären Wirkungen führen kann. Der Abfall der Serumkaliumspiegel ist normalerweise vorübergehend und erfordert keine Supplementierung. Bei Patienten mit schwerer COPD kann die Hypokaliämie durch Hypoxie und die Begleittherapie verstärkt werden (siehe Abschnitt «Interaktionen»). Dies kann die Neigung zu Herzrhythmusstörungen erhöhen.
Hyperglykämie
Die Inhalation hoher Dosen von Beta2-Adrenozeptor-Agonisten kann zu einem erhöhten Blutzuckerspiegel führen.
Spiolto Respimat sollte nicht zusammen mit anderen langwirksamen Beta2-Adrenozeptor-Agonisten angewendet werden. Patienten, die bisher regelmässig (z.B. viermal täglich) kurzwirksame Beta2-Adrenozeptor-Agonisten inhaliert haben, sind anzuweisen, diese nur noch zur Linderung bei akuten respiratorischen Symptomen anzuwenden.
Spiolto Respimat darf nicht häufiger als einmal täglich angewendet werden.
InteraktionenEs liegen keine gezielten Studien über Wechselwirkungen mit anderen Arzneimitteln vor.
Die Angaben in Bezug auf das mögliche Auftreten von Interaktionen bei Anwendung von Spiolto Respimat beruhen auf der Möglichkeit des Auftretens von Interaktionen bei Anwendung seiner beiden Bestandteile.
Tiotropiumbromid wurde gleichzeitig mit anderen üblicherweise in der Behandlung von COPD eingesetzten Arzneimitteln – wie Methylxanthinen sowie oralen und inhalativen Steroiden – ohne klinische Anzeichen für Wechselwirkungen angewendet.
Die Langzeitanwendung von Tiotropiumbromid zusammen mit anderen Anticholinergika wurde nicht untersucht. Daher wird die Langzeitanwendung von anderen Anticholinergika zusammen mit Spiolto Respimat nicht empfohlen.
Adrenergika
Bei gleichzeitiger Anwendung anderer Adrenergika können die Nebenwirkungen von Spiolto Respimat verstärkt werden.
Xanthinderivate, Steroide und Diuretika
Eine Begleittherapie mit Xanthinderivaten, Steroiden oder nicht kaliumsparenden Diuretika kann zu einer Verstärkung der hypokaliämischen Wirkung von Adrenozeptor-Agonisten führen (siehe Abschnitt «Warnhinweise und Vorsichtsmassnahmen»).
Betablocker
Beta-Rezeptorenblocker können die Wirkung von Olodaterol abschwächen oder antagonisieren. Unter solchen Umständen können kardioselektive Beta-Blocker in Erwägung gezogen werden, doch sind diese mit Vorsicht anzuwenden.
MAO-Hemmer und trizyklische Antidepressiva, QTc-verlängernde Arzneimittel
Monoaminoxidasehemmer, trizyklische Antidepressiva oder andere Arzneimittel, die bekanntermassen das QTc-Intervall verlängern, können die Wirkung von Spiolto Respimat auf das kardiovaskuläre System verstärken.
Pharmakokinetische Interaktionen
In einer Olodaterol-Wechselwirkungsstudie mit dem starken dualen CYP- und P-Gp-Hemmer Ketoconazol stieg die systemische Exposition um das etwa 1,7-fache (siehe Abschnitt «Pharmakokinetik»). In klinischen Olodaterol-Studien mit einer Dauer von bis zu einem Jahr mit Dosen, die bis zum 2-fachen der empfohlenen therapeutischen Dosis betrugen, ergaben sich keine Bedenken bezüglich der Sicherheit. Eine Dosisanpassung von Spiolto Respimat ist nicht erforderlich.
Schwangerschaft, StillzeitSchwangerschaft
Bisher liegen nur sehr begrenzte Erfahrungen mit der Anwendung von Tiotropium bei Schwangeren vor. Für Olodaterol liegen keine klinischen Daten über exponierte Schwangere vor.
Präklinische Studien mit Tiotropium ergaben keine Hinweise auf direkte oder indirekte gesundheitsschädliche Wirkungen in Bezug auf eine Reproduktionstoxizität in klinisch relevanten Dosen.
In präklinischen Untersuchungen zeigte Olodaterol in Dosierungen, die um ein Vielfaches über der therapeutischen Dosis lagen, die für Beta-Adrenozeptor-Agonisten typischen Wirkungen (siehe «Präklinische Daten»).
Aus Vorsichtsgründen soll eine Anwendung von Spiolto Respimat während der Schwangerschaft vermieden werden.
Der hemmende Effekt von Beta-Adrenozeptor-Agonisten wie Olodaterol (ein Bestandteil von Spiolto Respimat) auf die Uteruskontraktionen sollte berücksichtigt werden.
Stillzeit
Klinische Daten von stillenden Frauen mit Exposition gegenüber Tiotropium und/oder Olodaterol liegen nicht vor.
In präklinischen Studien mit Tiotropium und Olodaterol wurde die Substanz und/oder ihre Metabolite in der Milch laktierender Ratten nachgewiesen, es ist jedoch nicht bekannt, ob Tiotropium und/oder Olodaterol in die Muttermilch übergehen.
Daher sollte Spiolto Respimat bei stillenden Frauen nur angewendet werden, wenn der erwartete Nutzen das mögliche Risiko für das Kind überwiegt.
Fertilität
Für Tiotropium, Olodaterol und die Kombination der beiden Bestandteile liegen keine klinischen Daten zur Fertilität vor. In präklinischen Studien mit den Einzelsubstanzen Tiotropium und Olodaterol zeigten sich keine schädlichen Auswirkungen auf die Fertilität (siehe Präklinische Daten).
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenEs wurden keine Studien zu den Auswirkungen des Arzneimittels auf die Fähigkeit zum Lenken von Fahrzeugen und zum Bedienen von Maschinen durchgeführt.
Allerdings sollten die Patienten darauf hingewiesen werden, dass nach Anwendung von Spiolto Respimat über Schwindel und Verschwommensehen berichtet wurde. Daher sollte beim Lenken eines Fahrzeugs oder Bedienen von Maschinen zu Vorsicht geraten werden. Beim Auftreten der genannten Symptome sollten die Patienten potenziell gefährliche Tätigkeiten wie das Lenken eines Fahrzeugs oder das Bedienen von Maschinen vermeiden
Unerwünschte WirkungenDas klinische Entwicklungsprogramm von Spiolto Respimat umfasste mehr als 19000 COPD-Patienten. Von diesen erhielten über 5900 eine Dosis von 5 μg Tiotropium und 5 μg Olodaterol.
Die Nebenwirkungen von Spiolto Respimat wurden vorwiegend anhand der Daten aus 2 wirkstoffkontrollierten klinischen Langzeitstudien im Parallelgruppen-Design (52 Wochen) an COPD Patienten ermittelt, welche Spiolto Respimat mit Tiotropium und Olodaterol verglichen. Zusätzlich wurde eine weitere aktivkontrollierte Parallelgruppen-Langzeitbehandlungstudie (52 Wochen) mit COPD Patienten durchgeführt, die Spiolto Respimat mit Tiotropium verglichen (Studie 9).
In den zwei Zulassungsstudien (Studie 1 und 2) war die Gesamtinzidenz von Nebenwirkungen bei mit Spiolto Respimat behandelten Patienten mit der bei Patienten vergleichbar, die nur mit dem Einzelwirkstoff Olodaterol in einer Dosis von 5 μg behandelt wurden (74% bzw. 76,6%).
In der gepoolten Analyse aller drei klinischen Langzeitstudien (Studien 1,2 und 9) war die Gesamtinzidenz der Nebenwirkungen für die mit Spiolto Respimat und die mit den Einzelsubstanzen Tiotropium (Dosierung von 5 μg) bzw. Olodaterol (Dosierung von 5 μg) behandelten Patienten vergleichbar (74,1% bzw. 74,3%). Alle Nebenwirkungen, die bereits für die jeweiligen Einzelbestandteile beschrieben wurden, werden auch als Nebenwirkungen von Spiolto Respimat angesehen und sind in der nachstehenden Liste enthalten.
In Studie 9, an der über 3900 COPD-Patienten teilnahmen, welche mit Spiolto Respimat behandelt wurden, wurden keine neuen Nebenwirkungen ermittelt; darüber hinaus war das Sicherheitsprofil mit dem in den Zulassungsstudien dokumentierten Profil konsistent.
Zusätzlich sind Nebenwirkungen angegeben, die unter Spiolto Respimat, jedoch nicht unter den Einzelbestandteilen aufgetreten sind.
Nachfolgend sind die unerwünschten Wirkungen nach Organsystem und Häufigkeit, welche in klinischen Studien und während der Marktüberwachung unter Spiolto Respimat angegeben wurden. Die Häufigkeiten sind dabei wie folgt definiert:
Häufig: ≥1%-<10%; gelegentlich; ≥0.1%-<1%; selten: ≥0.01%-<0.1%; sehr selten: <0.01%; nicht bekannt: basierend überwiegend auf Spontanmeldungen aus der Marktüberwachung, genaue Häufigkeit kann nicht abgeschätzt werden).
Infektionen und parasitäre Erkrankungen
Nicht bekannt: Nasopharyngitis.
Stoffwechsel- und Ernährungsstörungen
Nicht bekannt: Dehydrierung.
Erkrankungen des Nervensystems
Gelegentlich: Schwindel.
Selten: Insomnie.
Augenerkrankungen
Selten: Verschwommensehen.
Nicht bekannt: Glaukom, erhöhter Augeninnendruck.
Herzerkrankungen:
Gelegentlich: Tachykardie.
Selten: Supraventrikuläre Tachykardie, Vorhofflimmern, Palpitationen.
Gefässerkrankungen:
Selten: Hypertonie.
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Gelegentlich: Husten, Dysphonie.
Selten: Epistaxis, Laryngitis, Pharyngitis, Bronchospasmen.
Nicht bekannt: Sinusitis.
Erkrankungen des Gastrointestinaltrakts
Gelegentlich: Mundtrockenheit.
Selten: Gingivitis, Oropharyngeale Candidose, Stomatitis, Obstipation.
Nicht bekannt: Darmobstruktion einschliesslich paralytischer Ileus, Dysphagie, Gastroösophagealer Reflux, Glossitis.
Erkrankungen der Haut und des Unterhautzellgewebes
Selten: Angioödem, Urtikaria, Pruritus, Überempfindlichkeitsreaktionen (einschliesslich allergischer Reaktionen vom Soforttyp), Hautausschlag.
Nicht bekannt: Trockene Haut, Hautinfektionen und -geschwüre.
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Selten: Rückenschmerzen1, Arthralgie, Gelenkschwellungen.
Erkrankungen der Nieren und Harnwege
Selten: Harnretention (für gewöhnlich bei prädisponierten Männern), Dysurie, Harnwegsinfekte.
1 Nebenwirkungen, die unter Spiolto Respimat, jedoch nicht unter den Einzelbestandteilen aufgetreten sind
Viele der aufgeführten Nebenwirkungen können den anticholinergen Eigenschaften von Tiotropium oder den beta-adrenergen Eigenschaften von Olodaterol – den Bestandteilen von Spiolto Respimat – zugeschrieben werden.
Ferner ist auf Anzeichen anderer beta-adrenerger Nebenwirkungen, die nicht oben aufgelistet sind, zu achten; hierzu zählen Arrhythmie, Myokardischämie, Angina pectoris, Hypotonie, Tremor, Kopfschmerzen, Nervosität, Übelkeit, Muskelkrämpfe, Erschöpfung, Unwohlsein, Hypokaliämie, Hyperglykämie und metabolische Azidose.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungAnzeichen und Symptome
In hohen Dosen kann Tiotropium zu anticholinergen Zeichen und Symptomen führen.
Auch nach Dosierungen von bis zu 40 µg Tiotropium-Inhalationslösung über 14 Tage wurden bei gesunden Probanden, abgesehen von einer deutlichen Reduzierung des Speichelflusses ab dem 7. Tag, keine relevanten Nebenwirkungen beobachtet, die über Mund- und Rachentrockenheit und trockene Nasenschleimhaut mit dosisabhängiger [10 - 40 μg pro Tag] Inzidenz hinausgingen.
In sechs Langzeitstudien an COPD-Patienten wurden bei einer Tagesdosis von 10 μg Tiotropium-Inhalationslösung über 4 bis 48 Wochen keine signifikanten Nebenwirkungen beobachtet.
Eine Überdosierung von Olodaterol führt voraussichtlich zu den für Beta2-Adrenozeptor-Agonisten typischen Symptomen wie Myokardischämie, Hypertonie oder Hypotonie, Tachykardie, Arrhythmien, Palpitationen, Schwindel, Nervosität, Schlaflosigkeit, Angstzustände, Kopfschmerzen, Zittern, Mundtrockenheit, Muskelkrämpfe, Übelkeit, Erschöpfung, Unwohlsein, Hypokaliämie, Hyperglykämie und metabolische Azidose.
Behandlung
Die Behandlung mit Spiolto Respimat ist abzubrechen. Eine unterstützende und symptomatische Behandlung ist angezeigt, in schweren Fällen eine Hospitalisierung. Die Gabe kardioselektiver Betablocker kann erwogen werden, sollte aber mit grösster Vorsicht erfolgen, da Betablocker Bronchospasmen auslösen können.
Eigenschaften/WirkungenATC-Code
R03AL06
Wirkungsmechanismus
Pharmakodynamik
Spiolto Respimat:
Tiotropium, ein langwirksamer, spezifischer Muskarin-Rezeptor-Antagonist und Olodaterol, ein langwirksamer Beta2-Agonist, werden zusammen im Spiolto Respimat Inhalator angewendet. Diese beiden Wirkstoffe führen aufgrund ihrer unterschiedlichen Wirkmechanismen und Zielrezeptoren in der Lunge zu einer additiven Bronchodilatation.
Tiotropium: Tiotropiumbromid ist ein langwirksamer, spezifischer Muskarin-Rezeptor-Antagonist (LAMA), der in der klinischen Medizin häufig als Anticholinergikum bezeichnet wird und die gleiche Affinität zu den Muskarin-Rezeptor-Subtypen M1 bis M5 aufweist. In den Atemwegen führt die Hemmung der M3-Rezeptoren der glatten Muskulatur zur Relaxation. Der kompetitive und reversible Charakter des Antagonismus wurde an menschlichen und tierischen Rezeptoren sowie an isolierten Organpräparaten nachgewiesen. In präklinischen invitro- und invivo-Studien war der bronchoprotektive Effekt dosisabhängig und hielt länger als 24 Stunden an. Die lange Wirkungsdauer ist wahrscheinlich auf die sehr langsame Dissoziation von den M3-Rezeptoren zurückzuführen. Sie zeigen eine signifikant längere Dissoziationshalbwertzeit als bei Ipratropium. Als N-quaternäres Anticholinergikum ist Tiotropium bei inhalativer Verabreichung topisch (broncho-)selektiv und zeigt eine ausreichende therapeutische Breite, ehe systemische anticholinerge Wirkungen auftreten können. Die Dissoziation vom M2-Rezeptor ist schneller als die vom M3-Rezeptor, was sich in invitro-Studien funktionell als kinetisch kontrollierte Rezeptorselektivität von M3 gegenüber M2 zeigte.
Die hohe Wirkstärke und langsame Rezeptordissoziation korreliert klinisch mit einer signifikanten und langwirksamen Bronchodilatation bei COPD-Patienten.
Bei der Bronchodilatation handelt es sich primär um eine lokale Wirkung (in den Atemwegen) und nicht um eine systemische Wirkung.
Olodaterol: Weist eine hohe Affinität und Selektivität für den humanen Beta2-Adrenozeptor auf. In-vitro-Studien haben gezeigt, dass Olodaterol an Beta2-Adrenozeptoren eine 241fach stärkere agonistische Wirkung als an Beta1-Adrenozeptoren und eine 2299-fach stärkere agonistische Wirkung als an Beta3-Adrenozeptoren ausübt. Die pharmakologischen Wirkungen dieses Wirkstoffes beruhen auf der Bindung und Aktivierung von Beta2-Adrenozeptoren nach topischer Verabreichung durch Inhalation.
Die Aktivierung dieser Rezeptoren in den Atemwegen führt zu einer Stimulierung der intrazellulären Adenylatzyklase, eines Enzyms, das die Synthese von zyklischem Adenosin-3',5'-monophosphat (cAMP) vermittelt. Ein erhöhter cAMP-Spiegel löst über die Relaxation der glatten Muskulatur in den Atemwegen eine Bronchodilatation aus.
Olodaterol besitzt das präklinische Profil eines langwirksamen selektiven Beta2-Adrenozeptor-Agonisten (LABA) mit schnellem Wirkungseintritt und einer Wirkdauer von mindestens 24 Stunden.
Beta-Adrenozeptoren werden in drei Subtypen eingeteilt, wobei Beta1-Adrenozeptoren vorwiegend in der Herzmuskulatur, Beta2-Adrenozeptoren vorwiegend auf der glatten Muskulatur der Atemwege und Beta3-Adrenozeptoren überwiegend in Fettgewebe exprimiert werden. Beta2-Agonisten führen zur Bronchodilatation. Der Beta2-Adrenozeptor ist zwar der vorherrschende adrenerge Rezeptor in der glatten Muskulatur der Atemwege, doch findet er sich auch auf der Oberfläche verschiedener anderer Zellen, z.B. auf Lungenepithel, Endothelzellen und im Herzen. Die genaue Funktion der Beta2-Rezeptoren im Herzen ist nicht bekannt, doch lässt ihr Vorhandensein darauf schliessen, dass selbst hochselektive Beta2-Adrenozeptor-Agonisten kardiale Wirkungen ausüben könnten.
Klinische Studien
Wirkung auf die Elektrophysiologie des Herzens
Tiotropium: Die Wirkung von Tiotropium Pulver zur Inhalation auf das QT-Intervall wurde in einer randomisierten, placebo- und wirkstoffkontrollierten Crossover-Studie an 53 gesunden Probanden untersucht. Die Patienten erhielten 12 Tage lang Tiotropium Pulver zur Inhalation 18 μg, 54 μg (das Dreifache der empfohlenen Dosis) oder Placebo. Die EKG-Untersuchungen erfolgten zu Baseline und im Dosierungsintervall nach der ersten und der letzten Gabe des Prüfpräparats. Tiotropium Pulver zur Inhalation 18 bzw. 54 μg führte im Vergleich zu Placebo zu einer maximalen mittleren Veränderung des studienspezifischen QTc-Intervalls um 3,2 ms bzw. 0,8 ms gegenüber Baseline. Bei keinem Probanden kam es zu einem erneuten Anstieg des QTc-Intervalls auf >500 ms oder einer Veränderung des QTc-Intervalls um ≥60 ms gegenüber Baseline.
Olodaterol: Die Wirkung von Olodaterol auf das QT/QTc-Intervall im EKG wurde in einer doppelblinden, randomisierten, placebo- und wirkstoff (Moxifloxacin)-kontrollierten Studie an 24 gesunden männlichen und weiblichen Probanden untersucht. Olodaterol in Einzeldosen von 10, 20, 30 und 50 μg führte über einen Zeitraum von 20 Minuten bis 2 Stunden nach der Verabreichung im Vergleich zu Placebo zu einer dosisabhängigen Zunahme der mittleren Veränderung des QT-Intervalls von 1,6 ms (10 μg Olodaterol) bis 6,5 ms (50 μg Olodaterol) gegenüber Baseline. Die Obergrenze des zweiseitigen 90%-Konfidenzintervalls lag auf allen Dosisstufen unter 10 ms.
Die Wirkung von 5 μg und 10 μg Olodaterol auf die Herzfrequenz und den Herzrhythmus wurden im Rahmen der 48wöchigen placebokontrollierten Phase-III-Studien anhand einer kontinuierlichen EKG-Aufzeichnung über 24 Stunden (Langzeit-EKG) in einer Untergruppe von 772 Patienten untersucht. Dabei wurden hinsichtlich der Grössenordnung der mittleren Veränderungen von Herzfrequenz oder Extrasystolen keine dosis- oder zeitbedingten Tendenzen oder Muster beobachtet. Veränderungen der Extrasystolie zwischen Baseline und Behandlungsende ergaben keinen Hinweis auf bedeutsame Unterschiede zwischen 5 μg bzw. 10 μg Olodaterol und Placebo.
Spiolto Respimat
In zwei 52-wöchigen, randomisierten, doppelblinden Studien mit Spiolto Respimat, an welchen 5162 COPD-Patienten teilnahmen, wurden EKG-Untersuchungen nach der Verabreichung an den Tagen 1, 85, 169 und 365 durchgeführt. In einer gepoolten Analyse der Anzahl der Patienten mit Veränderungen des Baseline-korrigierten QT-Intervalls >30 ms nach Bazett (QTcB) und Fridericia (QTcF) betrugen die Herzfrequenzkorrekturen des QT-Intervalls im Rahmen der durchgeführten Untersuchungen 4,9-6,4% (QTcB) und 3,3-4,7% (QTcF) für die Spiolto Respimat-Gruppe gegenüber 5,0-6,0% (QTcB) und 3,4-4,4% (QTcF) für Olodaterol 5 μg sowie 5,3-6,5% (QTcB) und 3,0-4,7% (QTcF) für Tiotropium 5 μg.
Klinische Wirksamkeit und Sicherheit
Das klinische Phase-III-Entwicklungsprogramm für Spiolto Respimat umfasste drei randomisierte, doppelblinde Studien:
(i) zwei replizierte, placebokontrollierte Parallelgruppenstudien über 52 Wochen zum Vergleich von Spiolto Respimat mit Tiotropium 5 μg und Olodaterol 5 μg (1029 Patienten erhielten Spiolto Respimat) [Studien 1 und 2]
(ii) eine 6wöchige Crossover-Studie zum Vergleich von Spiolto Respimat mit Tiotropium 5 μg, Olodaterol 5 μg und Placebo (139 Patienten erhielten Spiolto Respimat) [Studie 3]
In diesen Studien wurden die Vergleichssubstanzen Tiotropium 5 μg, Olodaterol 5 μg und Placebo über den Respimat Inhalator verabreicht.
In allen Studien wurde die Lungenfunktion untersucht (Einsekundenkapazität, FEV1). In den 52wöchigen Studien wurde die Lungenfunktion bis zu 3 Stunden nach Verabreichung (in einer Untergruppe von Patienten 12 Stunden nach Verabreichung) sowie 23-24 Stunden nach Verabreichung gemessen; die primären Wirksamkeitsendpunkte in Bezug auf die Lungenfunktion waren die Veränderung der FEV1 AUC0-3h gegenüber dem Ausgangswert vor Therapiebeginn (Ansprechen), sowie die Veränderung des FEV1-Tiefstwertes gegenüber dem Ausgangswert vor Therapiebeginn nach 24 Wochen. In der 6wöchigen Studie wurde die Lungenfunktion bis zu 12 Stunden nach Verabreichung sowie 22-24 Stunden nach Verabreichung gemessen; der primäre Wirksamkeitsendpunkt war die FEV1 AUC0-24h nach 6 Wochen. In den 52wöchigen Studien wurden ausserdem das St. George's Respiratory Questionnaire (SGRQ) als Mass der gesundheitsbezogenen Lebensqualität (primärer Endpunkt) und der Mahler Transition Dyspnea Index (TDI) als Mass der Dyspnoe (wichtiger sekundärer Endpunkt) verwendet.
In das Phase-III-Programm wurden Patienten im Alter von mindestens 40 Jahren mit klinisch diagnostizierter COPD, einer Raucheranamnese von mehr als 10 Packungsjahren und einer mittelgradigen bis schweren Beeinträchtigung der Lungenfunktion (postbronchodilatatorische FEV1 <80% des Sollwerts [GOLD-Stadien II-IV); postbronchodilatatorische FEV1/FVC-Ratio <70%]) aufgenommen.
Patientenmerkmale
Die Mehrzahl der 5162 Patienten, die für die globalen 52wöchigen Studien (Studien 1 und 2) rekrutiert wurden, war männlich (73%), «weiss» (71%) oder «asiatisch» (25%) und im Mittel 64 Jahre alt. Die mittlere postbronchodilatatorische FEV1 betrug 1,37 l (GOLD II [50%], GOLD III [39%], GOLD IV [11%]). Die mittlere Ansprechbarkeit für Beta2-Agonisten lag bei 16,6% des Ausgangswerts (0,171 l). Als Begleittherapie waren alle Atemwegstherapeutika (z.B. inhalative Steroide [47%] und Xanthine [10%]) zulässig.
Die 6-wöchige Studie (Studie 3) wurde in Europa und Nordamerika durchgeführt. Die Mehrzahl der 219 rekrutierten Patienten war männlich (59%), «weiss» (99%) und im Mittel 61,1 Jahre alt. Die mittlere postbronchodilatatorische FEV1 betrug 1,55 l (GOLD II [64%], GOLD III [34%], GOLD IV [2%]). Die mittlere Ansprechbarkeit für Beta2-Agonisten lag bei 15,9% des Ausgangswerts (0,193 l). Als Begleittherapie waren alle Atemwegstherapeutika (z.B. inhalative Steroide [41%] und Xanthine [4%]) zulässig.
Lungenfunktion
In den 52wöchigen Studien bewirkte Spiolto Respimat (einmal täglich morgens) innerhalb von 5 Minuten nach der ersten Dosis eine eindeutige Verbesserung der Lungenfunktion (mittlere Zunahme der FEV1 um 0,137 l) im Vergleich zu Tiotropium 5 μg (0,058 l, p<0,0001) und Olodaterol 5 μg (0,125 l, p=0,16). In beiden Studien wurde eine signifikante Verbesserung der FEV1 AUC0-3h und des FEV1-Tiefstwertes nach 24 Wochen (primäre Endpunkte der Lungenfunktion) für Spiolto Respimat gegenüber Tiotropium 5 μg und Olodaterol 5 μg festgestellt (Tabelle 1).
Tabelle 1: Differenz der FEV1 AUC0-3h-Werte und FEV1-Tiefstwerte für Spiolto Respimat zu Tiotropium 5 μg und Olodaterol 5 μg nach 24 Wochen (Studien 1 und 2).
|
|
FEV1 AUC0-3 h
|
FEV1-Tiefstwert
| |
Studie 1
|
Studie 2
|
Studie 1
|
Studie 2
| |
n
|
Mittelwert
|
n
|
Mittelwert
|
n
|
Mittelwert
|
n
|
Mittelwert
| |
Spiolto Respimat versus
|
522
|
--
|
502
|
--
|
521
|
--
|
497
|
--
| |
Tiotropium 5 μg
|
526
|
0,117 l
|
500
|
0,103 l
|
520
|
0,071 l
|
498
|
0,050 l
| |
Olodaterol 5 μg
|
525
|
0,123 l
|
507
|
0,132 l
|
519
|
0,082 l
|
503
|
0,088 l
|
FEV1-Ausgangswert vor Therapiebeginn: Studie 1 = 1,16 l;
Studie 2 = 1,15 l
p≤0,0001 für alle Vergleiche
Die im Vergleich zu Tiotropium 5 μg und Olodaterol 5 μg stärkere bronchodilatatorische Wirkung von Spiolto Respimat hielt über die gesamte 52wöchige Behandlungsphase hinweg an. Spiolto Respimat führte im Vergleich zu Tiotropium 5 μg und Olodaterol 5 μg ausserdem zu einer Verbesserung der morgendlichen und abendlichen maximalen exspiratorischen Atemflussrate (PEFR), die anhand der täglichen Aufzeichnungen der Patienten ermittelt wurde.
In der Untergruppe von Patienten, an welchen bis zu 12 Stunden nach Verabreichung erweiterte Lungenfunktionsmessungen vorgenommen wurden, zeigte Spiolto Respimat über das gesamte 24-Stunden-Dosierintervall eine signifikant stärkere Wirkung auf die FEV1 als Tiotropium 5 μg und Olodaterol 5 μg (Abbildung 1, Tabelle 2).
Abbildung 1: FEV1-Profil für Spiolto Respimat, Tiotropium 5 μg und Olodaterol 5 μg über das gesamte 24stündige Dosierintervall nach 24 Wochen (Untergruppe aus den Studien 1 und 2 mit 12stündigen PFT; kombinierter Datensatz)
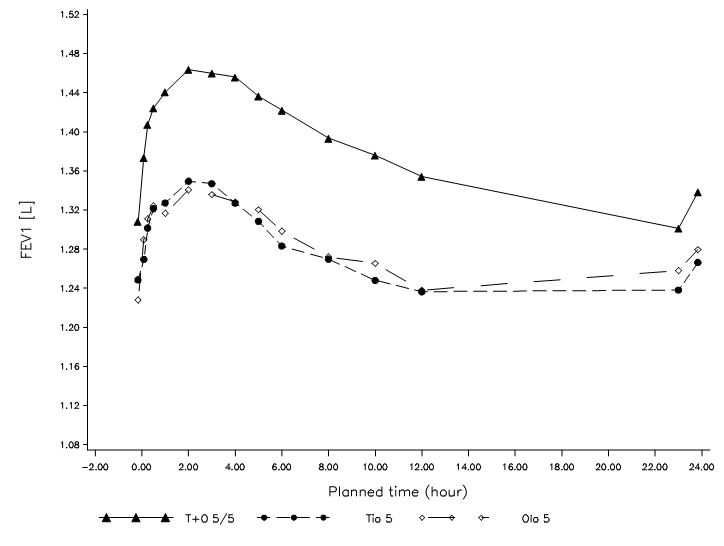
Tabelle 2: Differenz der FEV1 für Spiolto Respimat zu Tiotropium 5 μg und Olodaterol 5 μg über das gesamte 24stündige Dosierintervall nach 24 Wochen ((Untergruppe aus den Studien 1 und 2 mit 12stündigen PFT; kombinierter Datensatz)
|
|
n
|
12 h Durchschnitt
|
24 h Durchschnitt
| |
Spiolto Respimat versus
|
167
|
|
| |
Tiotropium 5 μg
|
160
|
0,123
|
0,106
| |
Olodaterol 5 μg
|
194
|
0,118
|
0,098
|
FEV1-Ausgangswert vor Therapiebeginn = 1,17 l
p<0,0001 für alle Vergleiche
In der 6wöchigen Studie zeigte Spiolto Respimat über das gesamte 24-Stunden-Dosierintervall eine signifikant stärkere Wirkung auf die FEV1 als Tiotropium 5 μg, Olodaterol 5 μg und Placebo (Abbildung 2, Tabelle 3).
Abbildung 2: FEV1-Profil für Spiolto Respimat, Tiotropium 5 μg, Olodaterol 5 μg und Placebo über ein vollständiges 24stündiges Dosierintervall nach 6 Wochen (Studie 3)
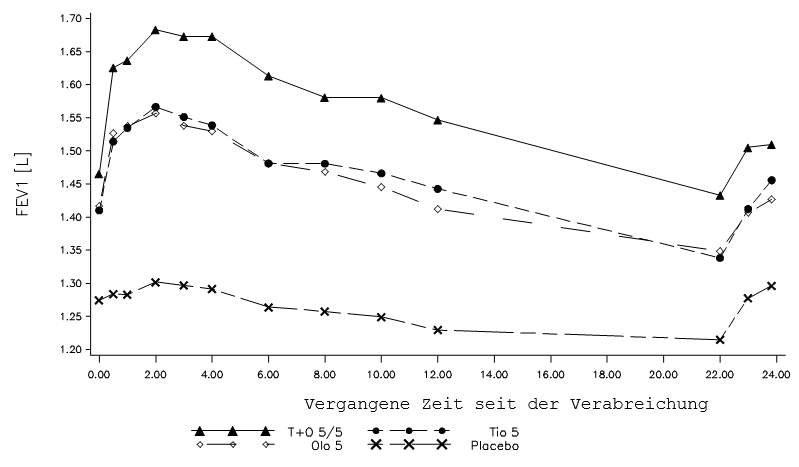
Tabelle 3: Differenz der FEV1 (l) für Spiolto Respimat zu Tiotropium 5 μg, Olodaterol 5 μg und Placebo über das gesamte 24stündige Dosierintervall nach 6 Wochen (Studie 3).
|
|
n
|
3 h Durchschnitt
|
n
|
12 h Durchschnitt
|
24 h Durchschnitt1
|
Tiefstwert
| |
Spiolto Respimat versus
|
138
|
|
138
|
|
|
| |
Tiotropium 5 μg
|
137
|
0,109
|
135
|
0,119
|
0,110
|
0,079
| |
Olodaterol 5 μg
|
138
|
0,109
|
136
|
0,126
|
0,115
|
0,092
| |
Placebo
|
135
|
0,325
|
132
|
0,319
|
0,280
|
0,207
|
FEV1-Ausgangswert vor Therapiebeginn = 1,30 l
1 Primärer Endpunkt
p<0,0001 für alle Vergleiche
Gesundheitsbezogene Lebensqualität
Nach 24 Wochen war der mittlere SGRQ-Gesamtscore unter Spiolto Respimat gegenüber Tiotropium 5 μg und Olodaterol 5 μg signifikant verbessert (Tabelle 4), wobei in allen SGRQ-Domänen Verbesserungen festgestellt wurden. Eine grössere Anzahl der mit Spiolto Respimat behandelten Patienten zeigte eine klinisch relevante Verbesserung des SGRQ-Gesamtscores (geringster klinisch relevanter Unterschied [MCID], definiert als Abnahme von mindestens 4 Einheiten im Vergleich zum Ausgangswert) als Patienten unter Tiotropium 5 μg (57,5% versus 48,7%, p=0,0001) bzw. Olodaterol 5 μg (57,5% versus 44,8%, p<0,0001).
Tabelle 4: SGRQ (Gesamt- und Domain-Scores) nach 24 Behandlungswochen
(Studie 1 (TOnado™ 1) und Studie 2 (TOnado™ 2)
|
|
n
|
Mittelwert nach Behandlungsgruppe (Veränderung gegenüber dem Ausgangswert
|
Differenz zu Spiolto Respimat
| |
Mittel-wert (p-Wert)
| |
Gesamtscore
|
Ausgangswert
|
|
43,5
|
| |
Spiolto Respimat
|
979
|
36,7 (-6,8)
|
| |
Tiotropium 5 μg
|
954
|
37,9 (-5,6)
|
-1,23 (p=0,025)
| |
Olodaterol 5 μg
|
954
|
38,4 (-5,1)
|
-1,69 (p=0,002)
| |
Symptome
|
Ausgangswert
|
|
51,9
|
| |
Spiolto Respimat
|
982
|
42,6
|
| |
Tiotropium 5 μg
|
957
|
45,5
|
-2,94 (p=0,0008)
| |
Olodaterol 5 μg
|
958
|
45,0
|
-2,48 (p=0,0046)
| |
Aktivität
|
Ausgangswert
|
|
58,0
|
| |
Spiolto Respimat
|
981
|
51,9
|
| |
Tiotropium 5 μg
|
959
|
53,2
|
-1,34 (p=0,052)
| |
Olodaterol 5 μg
|
958
|
54,0
|
-2,11 (p=0,002)
| |
Auswirkungen
|
Ausgangswert
|
|
32,6
|
| |
Spiolto Respimat
|
983
|
26,1
|
| |
Tiotropium 5 μg
|
960
|
26,8
|
-0,67 (p=0,283)
| |
Olodaterol 5 μg
|
959
|
27,2
|
-1,11 (p=0,075)
|
In zwei zusätzlichen 12-wöchigen, placebokontrollierten klinischen Studien (Studie 7 (OTEMTO™1 ) und Studie 8 (OTEMTO™2) wurde ausserdem der SGRQ-Gesamt-Score nach 12 Wochen, der ein Mass für die gesundheitsbezogene Lebensqualität darstellt, als primärer Endpunkt einbezogen.
In den 12-wöchigen Studien bewirkte Spiolto Respimat im Vergleich zu Placebo in Woche 12 eine Verbesserung des mittleren SGRQ-Gesamt-Scores (primärer Endpunkt) um −4,9 (95%-KI: −6,9, −2,9; p <0,0001) bzw. −4,6 (95%-KI: −6,5, −2,6; p <0,0001). In einer gepoolten supportiven Analyse der 12-wöchigen Studien war der prozentuale Anteil der Patienten mit einer klinisch bedeutsamen Besserung des SGRQ-Gesamt-Scores (definiert als Rückgang um mindestens 4 Einheiten gegenüber dem Ausgangswert) in Woche 12 in der mit Spiolto Respimat behandelten Gruppe höher (52%) als in der mit Tiotropium 5 Mikrogramm behandelten Gruppe (41%; Odds Ratio: 1,56 (95%-KI: 1,17, 2,07), p = 0,0022) und der Placebo-Gruppe (32%; Odds Ratio: 2,35 (95%-KI: 1,75, 3,16), p <0,0001).
Dyspnoe
Nach 24 Wochen war der mittlere TDI Focal Score unter Spiolto Respimat gegenüber Tiotropium 5 μg und Olodaterol 5 μg signifikant verbessert (Tabelle 5). Eine grössere Anzahl der mit Spiolto Respimat behandelten Patienten zeigte eine klinisch relevante Verbesserung des TDI Focal Score (MCID, definiert als Verbesserung um mindestens einen Punkt) als Patienten unter Tiotropium 5 μg (54,9% versus 50,6%, p=0,0546) bzw. Olodaterol 5 μg (54,9% versus 48,2%, p 0,0026).
Tabelle 5: TDI Focal Score nach 24 Behandlungswochen
(Studie 1 (TOnado™ 1) und Studie 2 (TOnado™ 2)
|
|
n
|
Mittelwert nach Behandlungsgruppe
|
Differenz zu Spiolto Respimat
| |
Mittelwert (p-Wert)
| |
Spiolto Respimat
|
992
|
1,98
|
| |
Tiotropium 5 μg
|
978
|
1,63
|
0,36 (p=0,008)
| |
Olodaterol 5 μg
|
984
|
1,56
|
0,42 (p=0,002)
|
Anwendung von Notfallmedikation
Die mit Spiolto Respimat behandelten Patienten wendeten sowohl tagsüber als auch nachts weniger Salbutamol als Notfallmedikation an als die Patienten, die Tiotropium 5 μg bzw. Olodaterol 5 μg erhielten.
PGR (Patient Global Rating)
Die mit Spiolto Respimat behandelten Patienten nahmen eine deutlichere Besserung ihrer Atemwegserkrankung wahr als die Patienten, die Tiotropium 5 μg bzw. Olodaterol 5 μg Placebo erhielten, wie anhand der PGR-Skala (Patient Global Rating) ermittelt wurde.
Exazerbationen
Gegenüber Tiotropium 5 μg wurde keine statistisch signifikante Reduktion des Risikos einer COPD-Exazerbation nachgewiesen. In dem kombinierten Datensatz von den 52-wöchigen Pivot-Studien betrug der Anteil der Patienten mit einer mittelgradigen/schweren COPD-Exazerbation 27,7% für Spiolto Respimat und 28,8% für Tiotropium 5 μg. Diese Studie war nicht speziell darauf ausgerichtet, die Therapiewirkungen auf COPD-Exazerbationen zu erfassen.
In Studie 9 wurde bei Patienten mit schwerer bis sehr schwerer COPD unter Spiolto Respimat eine numerisch tiefere Jahres-Rate mittelschwerer-schwerer COPD Exazerbationen gefunden, als unter Tiotropium 5 mcg allein (0.90 versus 0.97). Der Unterschied war aber statistisch nicht signifikant.
Inspiratorische Kapazität, Atembeschwerden und körperliche Ausdauer
Die Wirkung von Spiolto Respimat auf die inspiratorische Kapazität, Atembeschwerden und die symptomlimitierte körperliche Ausdauer wurde in drei randomisierten, doppelblinden Studien an COPD-Patienten untersucht:
(i) zwei replizierte 6wöchige Cross-Over-Studien zum Vergleich von Spiolto Respimat mit Tiotropium 5 μg, Olodaterol 5 μg und Placebo bei konstanter Belastung auf dem Fahrradergometer (450 Patienten erhielten Spiolto Respimat) [Studien 4 und 5]
(ii) eine 12wöchige Parallelgruppenstudie zum Vergleich von Spiolto Respimat mit Placebo bei jeweils konstanter Belastung auf dem Fahrradergometer (139 Patienten erhielten Spiolto Respimat) und dem Laufbandergometer (Untergruppe von Patienten) [Studie 6]
Spiolto Respimat verbesserte signifikant die inspiratorische Kapazität im Vergleich zu Tiotropium 5 μg, Olodaterol 5 μg und Placebo nach 6 Wochen (Studien 4 und 5; Tabelle 6) sowie zu Placebo nach 12 Wochen (0,234 l, p<0,0001; Studie 6).
Tabelle 6: Differenz der inspiratorischen Kapazität in Ruhe (IC) (l) für Spiolto Respimat zu Tiotropium 5 μg, Olodaterol 5 μg und Placebo nach 6 Wochen (Studien 4 und 5)
|
|
n
|
Studie 41
|
n
|
Studie 52
| |
Spiolto Respimat versus
|
219
|
|
218
|
| |
Tiotropium 5 μg
|
213
|
0,114 (p<0,0001)
|
208
|
0,088 (p=0,0005)
| |
Olodaterol 5 μg
|
214
|
0,119 (p<0,0001)
|
208
|
0,080 (p=0,0015)
| |
Placebo
|
211
|
0,244 (p<0,0001)
|
202
|
0,265 (p<0,0001)
|
1 Ausgangswert vor Therapiebeginn: 2,53 l
2 Ausgangswert vor Therapiebeginn: 2,59 l
In den Studien 4 und 5 verlängerte Spiolto Respimat die Ausdauerzeit bei konstanter Belastung auf dem Fahrradergometer im Vergleich zu Placebo um 20,9% bzw. 13% (Tabelle 7). In Studie 6 verlängerte Spiolto Respimat die Ausdauerzeit bei konstanter Belastung auf dem Fahrradergometer nach der ersten Dosis um 12,6% (in einer Untergruppe von Patienten), nach 6 Wochen um 22,9% und nach 12 Wochen um 13,8% im Vergleich zu Placebo sowie die Ausdauerzeit bei konstanter Belastung auf dem Laufbandergometer (in einer Untergruppe von Patienten) nach 6 Wochen um 20,6% und nach 12 Wochen um 20,9% im Vergleich zu Placebo (Tabelle 8).
Tabelle 7: Geometrisches Mittel der Ausdauerzeit (s) bei konstanter Belastung auf dem Fahrradergometer für Spiolto Respimat im Vergleich zu Placebo nach 6 Wochen (Studien 4 und 5).
|
|
n
|
Studie 41
|
n
|
Studie 52
| |
Spiolto Respimat
|
212
|
454,1
|
216
|
465,7
| |
Placebo
|
209
|
375,5
|
205
|
410,8
| |
Ratio
|
|
1,209 (p<0,0001)
|
|
1,134 (p<0,0001)
|
1 Ausgangswert vor Therapiebeginn: 460,0 s
2 Ausgangswert vor Therapiebeginn: 434,3 s
Tabelle 8: Geometrisches Mittel der Ausdauerzeit (s) bei konstanter Belastung auf dem Fahrrad- bzw. Laufbandergometer für Spiolto Respimat im Vergleich zu Placebo nach 12 Wochen (Studie 6).
|
|
Radfahren
|
Gehen
| |
n
|
12 Wochen 1,2
|
n
|
12 Wochen 3,4
| |
Spiolto Respimat
|
80
|
527,5
|
59
|
376,4
| |
Placebo
|
77
|
463,6
|
50
|
311,4
| |
Ratio
|
|
1,138 (p=0,021)
|
|
1,209 (p=0,055)
|
1 Ausgangswert vor Therapiebeginn: 443,0 s;
2 primärer Endpunkt
3 Ausgangswert vor Therapiebeginn: 311,2 s;
4 wichtiger sekundärer Endpunkt
PharmakokinetikBei gleichzeitiger Inhalation von Tiotropium und Olodaterol waren die pharmakokinetischen Parameter für jeden Wirkstoff mit den Werten bei separater Inhalation vergleichbar.
Tiotropium und Olodaterol zeigen im therapeutischen Bereich eine lineare Pharmakokinetik. Bei wiederholter einmal täglicher Inhalation wird am Tag 7 der Steady State der Tiotropium-Plasmakonzentration erreicht. Der Steady State der Olodaterol-Plasmakonzentration wird bei wiederholter einmal täglicher Inhalation nach 8 Tagen erreicht. Die Akkumulation nahm im Vergleich zu einer Einzeldosis bis auf das 1,8fache zu.
Absorption
Tiotropium: Die bei jungen gesunden Probanden gemessenen Daten zur Ausscheidung im Urin lassen erwarten, dass ungefähr 33% der über den RespimatInhalator aufgenommenen Dosis in den systemischen Kreislauf gelangen. Oral verabreichte Lösungen weisen eine absolute Bioverfügbarkeit von 2 - 3% auf. Die maximale Plasmakonzentration von Tiotropium wird 5-7 Minuten nach Inhalation über den Respimat gemessen.
Vergleichende Daten zur systemischen Tiotropium-Exposition nach Inhalation mit dem Respimat oder HandiHaler® ergaben widersprüchliche Resultate und sind daher nur bedingt konklusiv: Bei COPD-Patienten wurden nach Inhalation von 2 Hüben Respimat (insgesamt 5 mcg) Plasma-Spitzenkonzentrationen im Steady State von 10,5 pg/ml beobachtet und nahmen rasch entsprechend einem Multikompartiment-Modell ab. Die niedrigste Plasmakonzentration im Steady State lag bei 1,60 pg/ml. Nach der Inhalation mit dem HandiHaler® (18 mcg) betrug die Plasma-Spitzenkonzentration von Tiotropium im Steady State 12,9 pg/ml, und die niedrigste Plasmakonzentration lag bei 1,71 pg/ml.
Diese Tiotropium-Expositionswerte, die in einer aktuelleren Bioäquivalenzstudie gemessen wurden, deuten auf eine geringere Exposition nach der Inhalation mit dem Respimat-Inhalator hin, als bei einer Inhalation mit dem HandiHaler; während frühere Studien auf eine höhere Exposition hindeuten (Studie 205.249: Ohne Korrektur für Nachweisgrenze 35% höhere Exposition für Respimat betreffend die maximal gemessene Konzentration im Steady State (C0.167,ss) und 31% höhere Urinausscheidung (Ae0-12,ss); Studie 205.250: 18% höhere C0.167,ss und 17% höhere Ae0-12,ss)).
Olodaterol: Bei gesunden Probanden wurde die absolute Bioverfügbarkeit von Olodaterol nach Inhalation auf etwa 30% geschätzt, wohingegen die absolute Bioverfügbarkeit bei Verabreichung als Lösung zum Einnehmen weniger als 1% betrug. Die maximale Plasmakonzentration von Olodaterol wird normalerweise innerhalb von 10 bis 20 Minuten nach Inhalation des Arzneimittels über den Respimat erreicht.
Distribution
Tiotropium: Ist zu 72% an Plasmaproteine gebunden und hat ein Verteilungsvolumen von 32 l/kg. Studien an Ratten haben gezeigt, dass Tiotropium die Blut-Hirn-Schranke nicht in relevantem Ausmass passiert.
Olodaterol: Ist zu etwa 60% an Plasmaproteine gebunden und hat ein Verteilungsvolumen von 1110 l.
Metabolismus
Tiotropium: Das Ausmass der Metabolisierung ist gering, was daraus hervorgeht, dass 74% einer intravenösen Dosis unverändert im Urin ausgeschieden werden. Der Ester Tiotropium wird nichtenzymatisch in eine Alkohol- und eine Säurekomponente (N-Methylscopin bzw. Dithienylglycolsäure) gespalten, die beide nicht an Muskarin-Rezeptoren binden.
In-vitro-Untersuchungen an humanen Lebermikrosomen und humanen Hepatozyten weisen darauf hin, dass ein weiterer Anteil des Wirkstoffes (<20% der Dosis nach intravenöser Gabe) durch Cytochrom-P450(CYP)2D6 und CYP3A4-abhängige Oxidation und nachfolgende Glutathion-Konjugation zu verschiedenen Phase-II-Metaboliten metabolisiert wird.
Olodaterol: Wird im Wesentlichen durch direkte Glucuronidierung sowie durch O-Demethylierung an der Methoxygruppe und nachfolgende Konjugation metabolisiert. Von den sechs bekannten Metaboliten bindet nur das unkonjugierte Demethylierungsprodukt (SOM 1522) an Beta2-Rezeptoren; dieser Metabolit ist jedoch nach langfristiger Inhalation der empfohlenen therapeutischen Dosis oder in bis zu 4fach höherer Dosierung im Plasma nicht nachweisbar. An der O-Demethylierung von Olodaterol sind die Cytochrom-P450-Isoenzyme CYP2C9 und CYP2C8 beteiligt, während CYP3A4 unbedeutend ist. An der Bildung von Olodaterol-Glucuroniden sind nachweislich die Isoformen UGT2B7, UGT1A1, UGT1A7 und UGT1A9 der Uridindiphosphat-Glycosyltransferase beteiligt.
Elimination
Tiotropium: Nach intravenöser Gabe wird Tiotropium hauptsächlich unverändert im Urin ausgeschieden (74%). Die Gesamtclearance bei jungen Probanden beträgt 880 ml/min. Bei COPD-Patienten liegt die Ausscheidung im Urin nach Inhalation bis zum Steady State bei 18,6% der Dosis, der Rest besteht hauptsächlich aus im Darm nicht resorbierter Substanz und wird mit den Fäzes ausgeschieden. Die renale Clearance von Tiotropium liegt über der glomerulären Filtrationsrate, was auf eine aktive Ausscheidung in den Urin hinweist. Die effektive Halbwertszeit von Tiotropium nach Inhalation liegt bei COPD Patienten zwischen 27 und 45 Stunden.
Olodaterol: Die Gesamtclearance von Olodaterol bei gesunden Probanden liegt bei 872 ml/min, die renale Clearance bei 173 ml/min. Die terminale Halbwertszeit nach intravenöser Gabe beträgt 22 Stunden. Nach Inhalation beträgt die terminale Halbwertszeit hingegen etwa 45 Stunden, was darauf hinweist, dass bei letzterer eher Resorptions- als Eliminationsprozesse eine Rolle spielen.
Nach intravenöser Gabe von 14Cmarkiertem Olodaterol wurden 38% der radioaktiven Dosis im Urin und 53% in den Fäzes nachgewiesen. Der nach intravenöser Gabe im Urin nachgewiesene Anteil an unverändertem Olodaterol betrug 19%. Nach oraler Anwendung wurden nur 9% der Radioaktivität im Urin nachgewiesen, der Hauptanteil (84%) hingegen in den Fäzes gefunden. Über 90% der Dosis wurden innerhalb von 6 Tagen nach intravenöser bzw. 5 Tagen nach oraler Verabreichung ausgeschieden. Nach Inhalation belief sich die Ausscheidung von unverändertem Olodaterol im Urin innerhalb des Dosierintervalls bei gesunden Probanden im Steady State auf 5-7% der Dosis.
Kinetik spezieller Patientengruppen
Tiotropium: Wie für alle überwiegend renal ausgeschiedenen Arzneimittel zu erwarten, war ein höheres Alter mit der Abnahme der renalen Tiotropium-Clearance (von 347 ml/min bei COPD-Patienten <65 Jahren bis zu 275 ml/min bei COPD-Patienten ≥65 Jahre) assoziiert. Dies führte nicht zu einem entsprechenden Anstieg der AUC0-6,ss oder der Cmax,ss.
Olodaterol: Eine pharmakokinetische Metaanalyse mit Daten aus 2 kontrollierten klinischen Studien mit 405 COPD-Patienten und 296 Asthma-Patienten zeigte, dass keine Dosisanpassung auf Grundlage der Auswirkung des Alters, des Geschlechts und des Körpergewichts auf die systemische Exposition gegenüber Olodaterol erforderlich ist.
Der Vergleich pharmakokinetischer Daten innerhalb und zwischen Olodaterol-Studien zeigte eine Tendenz zu einer höheren systemischen Exposition bei Japanern und anderen Asiaten gegenüber Kaukasiern.
In klinischen Olodaterol-Studien mit einer Dauer von bis zu einem Jahr, in denen Kaukasier und Asiaten Olodaterol in Dosen bis zum 2-fachen der empfohlenen therapeutischen Dosis erhielten, ergaben sich keine Bedenken bezüglich der Sicherheit.
Leberfunktionsstörungen
Tiotropium: Bei Patienten mit Leberfunktionsstörung ist kein Einfluss auf die Pharmakokinetik von Tiotropium zu erwarten. Tiotropium wird überwiegend renal ausgeschieden (74% bei jungen gesunden Probanden und durch eine einfache, nichtenzymatische Esterspaltung zu pharmakologisch inaktiven Produkten abgebaut.
Olodaterol: Bei Patienten mit leichter bis mittelgradiger Leberfunktionsstörung war die systemische Exposition gegenüber Olodaterol nicht beeinträchtigt. Die Auswirkung einer schweren Leberfunktionsstörung auf die systemische Exposition gegenüber Olodaterol wurde nicht untersucht.
Wechselwirkungen von Olodaterol:
Wechselwirkungsstudien wurden mit Fluconazol als Beispiel eines CYP2C9-Hemmers und Ketoconazol als starkem P-Gp- und CYP-Hemmer durchgeführt.
Fluconazol: Bei gleichzeitiger Gabe von 400 mg Fluconazol einmal täglich über 14 Tage wurde kein relevanter Effekt auf die systemische Exposition gegenüber Olodaterol festgestellt.
Ketoconazol: Bei gleichzeitiger Gabe von 400 mg Ketoconazol einmal täglich über 14 Tage erhöhte sich die Cmax von Olodaterol um 66% und die AUC0-1 um 68%.
Nierenfunktionsstörungen
Tiotropium: Bei COPD-Patienten mit geringgradiger Nierenfunktionsstörung (CLcr 50-80 ml/min) führte die einmal tägliche Inhalation von Tiotropium bis zum Steady State im Vergleich zu Patienten mit normaler Nierenfunktion (CLcr >80 ml/min) zu einem leichten Anstieg der AUC0,ss (zwischen 1,8% und 30% erhöht). Ähnliches wurde auch für die Cmax,ss beobachtet. Bei Patienten mit mittelgradiger bis schwerer Nierenfunktionsstörung (CLcr <50 ml/min) verdoppelte sich die Gesamtexposition nach intravenöser Gabe von Tiotropium im Vergleich zu Patienten mit normaler Nierenfunktion (Anstieg der AUC0-4h um 82% und der Cmax um 52%. Dies wurde durch Messungen nach Inhalation des Trockenpulvers bestätigt.
Olodaterol: Bei Patienten mit schwerer Nierenfunktionsstörung (CLcr <30 ml/min) war die systemische Exposition gegenüber Olodaterol im Durchschnitt um das 1,4fache erhöht. Angesichts der Sicherheitsdaten zur Olodaterol-Therapie aus klinischen Studien mit einer Dauer von bis zu einem Jahr mit Dosen, die bis zum 2fachen der empfohlenen therapeutischen Dosis betrugen, gab dieses Ausmass des Expositionsanstiegs keinen Anlass für Sicherheitsbedenken.
Präklinische DatenToxizität bei einmaliger Verabreichung
In den für die Kombination Tiotropium + Olodaterol an Mäusen und Ratten durchgeführten Studien zur Toxizität bei einmaliger Inhalation mit drei Dosisverhältnissen wurde eine geringe akute Toxizität nachgewiesen. Bei Mäusen betrug die ungefähre letale Dosis (ALD) 34,8+36,6 mg/kg für Tiotropium+Olodaterol im Verhältnis 1:1. Bei Ratten traten keine Todesfälle auf, daher betrugen die ALD >17,9+18,8 mg/kg für Tiotropium/Olodaterol im Verhältnis 1:1.
Langzeittoxizität (bzw. Toxizität bei wiederholter Verabreichung)
Zur Toxizität bei wiederholter Inhalation für die Kombination Tiotropium + Olodaterol wurden Studien an Ratten (4 Wochen) und Hunden (bis zu 13 Wochen) mit unterschiedlichen Dosisverhältnissen durchgeführt. In den 13wöchigen Studien an Hunden waren die Entwicklung des Körpergewichts, klinische Zeichen, Veränderungen im kardiovaskulären System und der entsprechenden Enzymaktivitäten sowie makroskopische und mikroskopische Pathologiebefunde charakteristisch für beta2-agonistische und anticholinerge Effekte. In den 13wöchigen Toxizitätsstudien mit dem Dosisverhältnis 1:1 für Tiotropium/Olodaterol betrugen die NOAEL 14+16 μg/kg/Tag.
Genotoxizität
Untersuchungen zur invitro-Mutagenität der Einzelsubstanzen Tiotropium bzw. Olodaterol ergaben keine Hinweise auf ein genotoxisches Potential. In einem in-vivo-Mikronukleus-Test am Knochenmark von Ratten war die Kombination Tiotropium+Olodaterol nach Inhalation von Dosen bis zu 2266+2174 μg/kg/Tag über 4 Wochen (Dosisverhältnis 1:1) frei von genotoxischem Potential.
Kanzerogenität
Für die Kombination wurden keine Kanzerogenitätsstudien durchgeführt.
Tiotropium: zeigte in entsprechenden Studien an Mäusen und Ratten keinerlei kanzerogenes Potential.
Olodaterol: die lebenslange Behandlung von Ratten induzierte bei Expositionen, die etwa das 2235fache bzw. 715fache der Exposition für die 5 μg-Dosis (systemische Exposition) betrugen, klassen- und nagetierspezifische Leiomyome im Mesovarium. Die lebenslange Behandlung von Mäusen induzierte bei Expositionen, die etwa das 477fache bis 3596fache der Exposition für die 5 μg-Dosis (systemische Exposition) betrugen, Tumore in der glatten Uterusmuskulatur (Leiomyome, Leiomyosarkome) sowie fokale Keimstrang-Stromahyperplasien und fokale luteale Hyperplasien im Ovar. Auch dies gilt als Klasseneffekt bei Nagetieren nach Mehrfachgabe. Beide Studien lassen hinsichtlich Kanzerogenität und chronischer Toxizität keine besonderen Gefahren von Olodaterol für den Menschen erkennen.
Im in-vivo-Mikronukleus-Test am Knochenmark von Ratten nach Inhalation (bis zum ca. 1092fachen der 5 μg-Dosis, bezogen auf die AUC(0-24h)) und den invitro-Tests zur Mutagenität (Ames-Test, Test an Lymphomzellen der Maus) war Olodaterol auch in sehr hohen Dosen frei von genotoxischem Potential. Bei Ratten wurde nach intravenöser Gabe von Dosen, die mindestens das 5500fache der 5 μg-Dosis (bezogen auf die AUC(0-24h)) betrugen, ein vermehrtes Auftreten von Mikronuklei beobachtet, was möglicherweise auf eine arzneimittelbedingte (kompensatorische) Erythropoese zurückzuführen ist.
Sonstige HinweiseHaltbarkeit
Das Arzneimittel darf nur bis zu dem auf dem Behälter mit «EXP» bezeichneten Datum verwendet werden.
Haltbarkeit nach Anbruch
Der Spiolto Respimat Inhalator ist spätestens 3 Monate nach der ersten Anwendung zu verwerfen.
Besondere Lagerungshinweise
Nicht über 30 °C lagern.
Nicht einfrieren.
Ausser Reichweite von Kindern aufbewahren.
Hinweise für die Handhabung
Siehe der Packung beigelegte Gebrauchsanweisung des Respimat Inhalator wiederverwendbar
Zulassungsnummer67352 (Swissmedic).
PackungenEinzelpackung: 1 wiederverwendbarer Respimat Inhalator und 1 Patrone mit 60 Hüben (30 therapeutische Dosen) (B)
Dreifachpackung: 1 wiederverwendbarer Respimat Inhalator und 3 Patronen mit 60 Hüben (90 therapeutische Dosen) (B)
ZulassungsinhaberinBoehringer Ingelheim (Schweiz) GmbH, Basel.
Stand der InformationMai 2021
|


