PharmakokinetikPropiverin wird fast vollständig aus dem Magen-Darm-Trakt resorbiert. Es unterliegt einem extensiven First-Pass-Metabolismus. Wirkungen an den Zellen der glatten Muskulatur der Harnblase sind durch den Wirkstoff sowie durch drei aktive Metabolite bedingt, die schnell in den Urin ausgeschieden werden.
Absorption
Nach oraler Gabe von Mictonorm 30 mg wird Propiverin aus dem Gastrointestinaltrakt resorbiert und erreicht maximale Plasmakonzentrationen nach 9,9 Stunden.
Die mittlere absolute Bioverfügbarkeit von Mictonorm 30 mg beträgt 60,8 ± 17,3% (arithmetischer Mittelwert aus AUC0-∞ (p.o.) / AUC0-∞ (i.v.)).
Nahrungsmittelaufnahme hat keinen Einfluss auf die Pharmakokinetik von Propiverin.
Die Bioverfügbarkeit von Propiverin nach Nahrungsmittelaufnahme betrug 99% im Vergleich zum Nüchternwert. Die Gabe der Hartkapsel führt zu Cmax -Werten von ca. 70 ng/ml, die innerhalb von 9,5 Stunden nach Gabe erreicht werden. Die Cmax-Werte des Hauptmetaboliten Propiverin-N-oxid werden durch Nahrungsmittel leicht erhöht (f = 1,26), die absorbierte Menge bleibt unverändert. Propiverin-N-oxid zeigte für alle pharmakokinetischen Parameter 90% Konfidenzintervall innerhalb der akzeptierten Grenzen.
Einschränkungen der Gabe in Bezug zur Nahrungsmittelaufnahme sind deshalb nicht notwendig.
Distribution
Nach Gabe von Mictonorm 30 mg wird ein Steady state (Fliessgleichgewicht) nach 4 bis 5 Tagen auf einem höheren Konzentrationsniveau als nach einer Einzelgabe erreicht (CMittelwert = 71 ng/ml).
Das Verteilungsvolumen wurde bei 21 gesunden Probanden nach intravenöser Gabe von Propiverinhydrochlorid bestimmt und lag zwischen 125 und 473 l (Mittelwert 279 l), was darauf hindeutet, dass eine grosse Menge des verfügbaren Propiverins in periphere Kompartimente verteilt wird. Die Plasmaprotein-Bindung beträgt 90 - 95% für die Stammverbindung und etwa 60% für den Hauptmetaboliten.
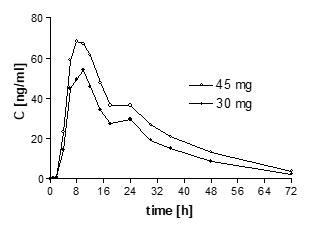
Pharmakokinetische Eigenschaften (geometrische Mittelwerte; ± SD-Intervall) von Propiverin bei 10 gesunden Probanden nach Einmalgabe von Propiverinhydrochlorid 30 mg und Propiverinhydrochlorid 45 mg Kapseln mit modifizierter Freisetzung:
|
Dosis [mg]
|
30
|
45
| |
ASC0-∞ [ng·h/ml]
|
1378
(903, 2104)
|
1909
(1002, 3639)
| |
Cmax [ng/ml]
|
60,6
(41,5, 88,6)
|
80,0
(41.8, 152.1)
| |
t½ [h]
|
14,2
(10,8, 18,6)
|
16,3
(13,9, 19,2)
| |
tmax [h]
|
9,9
± 2,4
|
9,9
± 2,4
|
Plasmakonzentrationen von Propiverin bei 10 gesunden Probanden nach Einmalgabe von Propiverinhydrochlorid 30 mg und Propiverinhydrochlorid 45 mg Kapseln mit modifizierter Freisetzung:
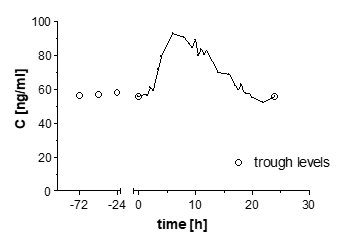
Steady-state-Eigenschaften von Propiverin nach wiederholter Gabe von Propiverinhydrochlorid 45 mg Kapseln mit modifizierter Freisetzung (s.i.d. über 7 Tage) an 24 gesunden Probanden:
|
|
Mittelwert
(geometrisch)
|
± SD-Intervall
| |
ASC0-24h [ng/h/ml]
|
1711
|
1079, 2713
| |
PTF* [%]
|
109,4
|
81.2, 147,5
| |
Caverage [ng/ml]
|
71
|
45,0, 113,0
| |
Cmax [ng/ml]
|
105
|
71, 155
| |
Cmin [ng/ml]
|
29
|
20, 42
| |
t½ [h]
|
20,4
|
12,8, 32,3
| |
tmax [h]
|
7,3
|
± 2,5
|
* PTF: peak-trough Fluktuation
Plasmakonzentrationen von Propiverin am Tag 7 und Tal-Plasmaspiegel nach wiederholter Gabe von Propiverinhydrochlorid 45 mg Kapseln mit modifizierter Freisetzung (s.i.d. über 7 Tage) bei 24 gesunden Probanden:
Metabolismus
Propiverin wird extensiv durch intestinale und hepatische Enzyme metabolisiert. Der Hauptabbauweg schliesst die Oxidation des Piperidyl-N ein und wird durch CYP 3A4 und die Flavin-haltigen Monooxygenasen (FMO) 1 und 3 vermittelt und führt zur Bildung des deutlich weniger aktiven N-Oxids, dessen Plasmakonzentration die der Ausgangssubstanz deutlich übersteigt. Vier Metaboliten wurden im Urin nachgewiesen, drei davon sind pharmakologisch aktiv und können zur therapeutischen Wirksamkeit beitragen.
In vitro ist eine geringfügige Hemmung von CYP 3A4 und CYP 2D6 messbar, die bei Konzentrationen auftritt, die die therapeutischen Plasmakonzentrationen um das 10- bis 100-fache übersteigen.
Elimination
Nach oraler Gabe von 30 mg 14C-Propiverinhydrochlorid an gesunde Probanden wurden innerhalb von 12 Tagen 60% der Radioaktivität im Urin und 21% der Radioaktivität in den Faeces gefunden. Weniger als 1% einer oralen Gabe wird unverändert mit dem Urin ausgeschieden. Die mittlere totale Clearance nach einmaliger Gabe von 30 mg beträgt 371 ml/min (191 - 870 ml/min).
Linearität/Nicht Linearität
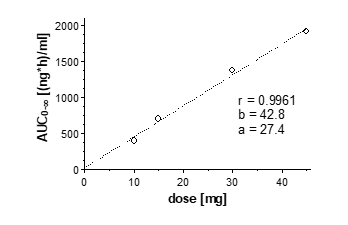
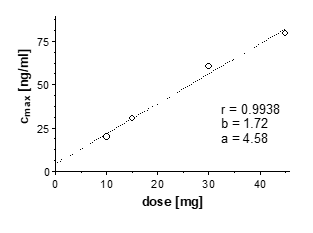
Die pharmakokinetischen Parameter von Propiverin und Propiverin-N-Oxid nach oraler Gabe von 10 – 45 mg Propiverinhydrochlorid stehen in einem linearen Zusammenhang mit der Dosis.
Korrelation zwischen oraler Dosis von Propiverin mit veränderter Wirkstofffreisetzung und resultierender AUC 0-∞
Korrelation zwischen oraler Dosis von Propiverin mit veränderter Wirkstofffreisetzung und resultierender Cmax:
Kinetik spezieller Patientengruppen
Leberfunktionsstörungen
Verglichen mit 12 gesunden Kontrollpersonen war die Steady-state-Pharmakokinetik ähnlich der von 12 Patienten mit milder bis moderater Leberfunktionseinschränkung durch eine Fettleber. Für schwere Leberfunktionseinschränkungen liegen keine Daten vor.
Nierenfunktionsstörungen
Aus einer Untersuchung mit einmaliger Gabe an 12 Patienten mit einer Kreatininclearance <30 ml/min wurde geschlussfolgert, dass eine schwere Nierenfunktionseinschränkung die Eliminierung von Propiverin und seinem Hauptmetaboliten Propiverin-N-Oxid nicht wesentlich ändert. Eine Dosisanpassung ist nicht notwendig.
Ältere Patienten
Der Vergleich von Tal-Plasmakonzentrationen während des Steady state zeigt keinen Unterschied zwischen älteren Patienten (60 – 85 Jahre; Mittelwert 68) und jungen gesunden Probanden. Das Verhältnis der Muttersubstanz zum Metaboliten bleibt bei älteren Patienten unverändert, was darauf hindeutet, dass die metabolische Umsetzung von Propiverin in seinen Hauptmetaboliten Propiverin-N-Oxid nicht altersabhängig oder nicht limitierend bei der Gesamtausscheidung ist.
Da in einer GCP-konformen Studie die Bioäquivalenz von Propiverinhydrochlorid 15 mg überzogenen Tabletten t.i.d. und Propiverinhydrochlorid 45 mg Hartkapseln mit veränderter Wirkstofffreisetzung s.i.d. gezeigt werden konnte, kann dasselbe für Mictonorm 30 mg Hartkapseln geschlussfolgert werden.
Patienten mit Glaukom
Die Behandlung mit Mictonorm 30 mg führt nicht zu einer Erhöhung des Augeninnendrucks bei Patienten mit Weitwinkelglaukom und bei Patienten mit behandeltem (kontrolliertem) Engwinkelglaukom. Dies wurde in 2 Placebo kontrollierten Studien mit Propiverinhydrochlorid 15 mg überzogene Tabletten t.i.d. über 7 Tage gezeigt.
|




