Eigenschaften/WirkungenATC-Code
N02CD05
Wirkungsmechanismus
Eptinezumab ist ein humanisierter monoklonaler Immunglobulin-G1 (IgG1)-Antikörper, der mit einer Affinität im niedrigen picomolaren Bereich (KD = 4 bzw. 3 pM) an die α- und β-Form des humanen CGRP (calcitonin gene-related peptide)-Liganden bindet und so dessen biologische Aktivität hemmt.
Erhöhte Blutkonzentrationen von CGRP wurden mit Migräneanfällen in Verbindung gebracht. Zusätzlich können CGRP Infusionen, bei Patienten mit Migräne in ihrer Vorgeschichte, migräneartige Anfälle auslösen.
Der genaue Wirkungsmechanismus von Eptinezumab bei der Prävention von Migräneattacken ist nicht bekannt. Es wird angenommen, dass die Migräneprävention u.a. durch eine Modulierung der Nozizeption im Trigeminussystems vermittelt wird.
Pharmakodynamik
Eptinezumab ist hochgradig selektiv und bindet an keines der verwandten Neuropeptide Amylin, Calcitonin, Adrenomedullin und Intermedin.
Klinische Wirksamkeit
Vyepti wurde in zwei Placebo-kontrollierten pivotalen Studien für die präventive Behandlung von Migräne untersucht: PROMISE 1 wurde bei Patienten mit episodischer Migräne (n=888), PROMISE 2 bei Patienten mit chronischer Migräne (n=1072) durchgeführt. Episodische Migräne war in PROMISE 1 definiert als ≤14 Kopfschmerztage, davon 4 Migränetage, in jedem 28-Tages-Zeitraum in den 3 Monaten vor dem Screening. Chronische Migräne war in PROMISE 2 definiert als ≥15 bis ≤26 Kopfschmerztage, von denen ≥8 als Migränetage beurteilt worden waren. Vyepti wurde in beiden Studien alle 12 Wochen durch intravenöse Infusion verabreicht.
PROMISE 1: Episodische Migräne
Bei PROMISE 1 handelte es sich um eine globale, doppelblinde, Placebo-kontrollierte Parallelgruppenstudie zur Beurteilung der Wirksamkeit und Sicherheit von Vyepti zur präventiven Behandlung von episodischer Migräne bei Erwachsenen. Insgesamt wurden 665 Patienten randomisiert und erhielten während 48 Wochen alle 12 Wochen Placebo (N=222), 100 mg Eptinezumab (N=221) oder 300 mg Eptinezumab (N=222) (4 Infusionen). Episodische Migräne war definiert als ≥4 und ≤14 Kopfschmerztage, von denen mindestens 4 Migränetage in jedem 28-Tage-Zeitraum in den 3 Monaten vor dem Screening sein mussten und während der Baseline-Periode bestätigt wurden. Den Patienten war es während der Studie erlaubt, begleitend akut wirkende Migräne- oder Kopfschmerzmedikamente einzunehmen, einschliesslich migränespezifischer Medikamente (z.B. Triptane, Ergotamin-Derivate). Die regelmässige Verwendung (mehr als 7 Tage pro Monat) anderer Behandlungen zur Prävention der Migräne war nicht gestattet.
Der primäre Wirksamkeitsendpunkt war die Änderung der monatlichen Migränetage (MMD) ab Studienbeginn über die Wochen 1–12. Zu den wichtigsten sekundären Endpunkten gehörten Migräne-Ansprechraten ≥50 % und ≥75 %, definiert als der Anteil der Patienten, die eine mindestens diesem Prozentwert entsprechende Verringerung der Migränetage über die Wochen 1–12 zeigten und eine Migräne-Ansprechrate ≥75 % über die Wochen 1–4. und der Prozentsatz der Patienten mit einer Migräne am Tag nach der ersten Verabreichung (Tag 1).
Die 4-wöchentlichen Ergebnisse über die Wochen 1–48 nach 4 vierteljährlichen Infusionen Vyepti sind als Veränderung der mittleren MMD ab Studienbeginn dargestellt (Abbildung 1). Beide Vyepti-Behandlungsgruppen (100 mg und 300 mg) zeigten ab Studienbeginn bis Woche 1–12 im Vergleich zu Placebo eine statistisch signifikante und klinisch relevante Verbesserung der mittleren MMD. Bei allen Zeitpunkten bis zu Woche 48 wurde im Vergleich zu Placebo eine grössere mittlere Abnahme der MMD unter beiden Dosen von Vyepti beobachtet.
Abbildung 1: Mittlere Veränderungen ab Baseline der mittleren monatlichen Migränetage im Zeitverlauf in PROMISE 1
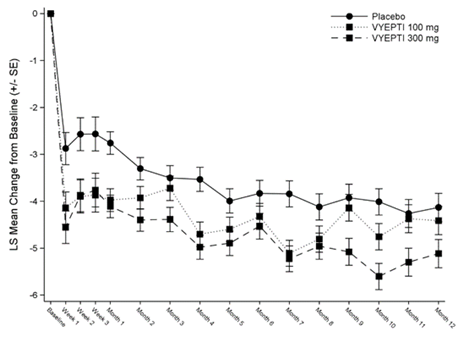
LS = least square; Vyepti = eptinezumab
Bei jedem Zeitpunkt wurde ANCOVA verwendet, die die Behandlung und den Einsatz prophylaktischer Medikamente als Faktoren und die Migränetage zu Studienbeginn als kontinuierliche Kovariante umfasste, um die mediane Änderung gegenüber dem Ausgangswert abzuschätzen.
Die Behandlung mit Vyepti zeigte statistisch signifikante und klinisch relevante Verbesserungen des primären und der wichtigsten sekundären Wirksamkeitsendpunkte, die in Tabelle 1 zusammengefasst werden.
Tabelle 1: Ergebnisse des primären und der wichtigsten sekundären Wirksamkeitsendpunkte in PROMISE 1 (episodische Migräne)
|
|
VYEPTI
100 mg
N=221
|
VYEPTI
300 mg
N=222
|
Placebo
N=222
| |
Monatliche Migränetage (MMD) – Woche 1–12
| |
Baseline
|
8.7
|
8.6
|
8.4
| |
Mittlere Veränderung
|
-3.9
|
-4.3
|
-3.2
| |
Differenz zu Placebo
|
-0.7
|
-1.1
|
| |
KI95%
|
(-1.3, -0.1)
|
(-1.7, -0.5)
|
| |
p-Wert vs. Placebo
|
0.0182
|
0.0001
|
| |
≥75 % MMD-Responder – Woche 1–12
| |
Responder
|
22.2 %
|
29.7 %
|
16.2 %
| |
Differenz zu Placebo
|
6.0 %
|
13.5 %
|
| |
p-Wert vs. Placebo
|
0.1126
|
0.0007
|
| |
≥50 % MMD-Responder – Woche 1–12
| |
Responder
|
49.8 %
|
56.3 %
|
37.4 %
| |
Differenz zu Placebo
|
12.4 %
|
18.9 %
|
| |
p-Wert vs. Placebo
|
0.0085
|
0.0001
|
|
PROMISE 2: Chronische Migräne
Bei PROMISE 2 handelte es sich um eine globale, doppelblinde, Placebo-kontrollierte Parallelgruppenstudie zur Beurteilung der Wirksamkeit und Sicherheit von Vyepti zur präventiven Behandlung von chronischer Migräne bei Erwachsenen. Insgesamt wurden 1072 Patienten randomisiert und erhielten während 24 Wochen alle 12 Wochen Placebo (N=366), 100 mg Eptinezumab (N=356) oder 300 mg Eptinezumab (N=350) (2 Infusionen). Chronische Migräne war definiert als ≥15 bis ≤26 Kopfschmerztage, von denen ≥8 in den 3 Monaten vor dem Screening als Migränetage bewertet und während des 28-tägigen Screeningzeitraums bestätigt wurden. Während der Studie war es den Patienten erlaubt, auf Basis eines festgelegten, stabilen Regimes akute oder präventive Medikamente gegen Migräne oder Kopfschmerzen (mit Ausnahme von Onabotulinumtoxin A) einzunehmen.
Insgesamt 431 Patienten (40%) mit der Doppeldiagnose einer chronischen Migräne und Kopfschmerz bei Medikamentenübergebrauch (im Zusammenhang mit dem Übergebrauch von Triptanen, Ergotamin oder kombinierten Analgetika >10 Tage/Monat oder Paracetamol, Acetylsalicylsäure oder nicht-steroidalen Antirheumatika ≥15 Tage/Monat) wurden in die Studienpopulation eingeschlossen. Patienten, die Opioide oder Butalbital enthaltende Arzneimittel >4 Tage/Monat einnehmen, wurden ausgeschlossen.
Der primäre Wirksamkeitsendpunkt war die Änderung der MMD ab Baseline über die Wochen 1–12. Zu den wichtigsten sekundären Endpunkten gehörten Migräne-Ansprechraten ≥50 % und ≥75 %, definiert als Anteil der Patienten, die eine mindestens diesem Prozentwert entsprechende Verringerung der Migränetage über die Wochen 1–12 erreichten, Migräne-Ansprechrate ≥75 % über die Wochen 1–4, der Prozentsatz der Patienten mit einer Migräne am Tag nach der ersten Verabreichung, die Veränderung der Gesamtpunktzahl im Kopfschmerz-Impact-Test (HIT-6) in Woche 12 gegenüber dem Ausgangswert (nur 300-mg-Dosis) und die Veränderung der monatlichen Migräne-Akutmedikationstage gegenüber dem Ausgangswert, Mittelwert über die Wochen 1–12 (nur 300-mg-Dosis). Beim HIT-6 handelt es sich um einen selbst ausgefüllten Fragebogen zur Beurteilung des Einflusses von Kopfschmerzen auf den funktionellen Status von Patienten mit Migräne. Die Interpretation des Einflusses der Migräne auf die Alltagsfunktion anhand der Gesamtpunktzahl ist wie folgt: 60–78 = schwerwiegend, 56–59 = beträchtlich, 50–55 = ein wenig, 36–49 = wenig bis kein Einfluss.
Die monatlichen Ergebnisse über die Wochen 1–24 nach zwei vierteljährlichen Infusionen Vyepti sind als Veränderung der mittleren MMD ab Studienbeginn dargestellt (Abbildung 2). Beide Vyepti-Behandlungsgruppen (100 mg und 300 mg) zeigten ab Studienbeginn Woche 1–12 im Vergleich zu Placebo eine statistisch signifikante und klinisch relevante Verbesserung der mittleren MMD. Bei allen Zeitpunkten bis zu Woche 24 wurde im Vergleich zu Placebo eine grössere mittlere Abnahme der MMD unter beiden Dosen von Vyepti beobachtet.
Abbildung 2: Mittlere Veränderungen ab Baseline der mittleren monatlichen Migränetage im Zeitverlauf in PROMISE 2

LS = least square; Vyepti = eptinezumab
Bei jedem Zeitpunkt wurde ANCOVA verwendet, die die Behandlung und den Einsatz prophylaktischer Medikamente als Faktoren und die Migränetage zu Studienbeginn als kontinuierliche Kovariante umfasste, um die mediane Änderung gegenüber dem Ausgangswert abzuschätzen.
Die Behandlung mit Eptinezumab zeigte statistisch signifikante und klinisch relevante Verbesserungen der wichtigsten Wirksamkeitsendpunkte, die in Tabelle 2 zusammengefasst werden.
Tabelle 2: Ergebnisse des primären und der wichtigsten sekundären Wirksamkeitsendpunkte in PROMISE 2 (chronische Migräne)
|
|
VYEPTI
100 mg
N=356
|
VYEPTI
300 mg
N=350
|
Placebo
N=366
| |
Monatliche Migränetage (MMD) – Woche 1–12
| |
Baseline
|
16.1
|
16.1
|
16.2
| |
Mittlere Veränderung
|
-7.7
|
-8.2
|
-5.6
| |
Differenz zu Placebo
|
-2.0
|
-2.6
|
| |
KI95%
|
(-2.9, -1.2)
|
(-3.5, -1.7)
|
| |
p-Wert vs. Placebo
|
< 0.0001
|
< 0.0001
|
| |
≥75 % MMD-Responder – Woche 1–12
| |
Responder
|
26.7 %
|
33.1 %
|
15.0 %
| |
Differenz zu Placebo
|
11.7 %
|
18.1 %
|
| |
p-Wert vs. Placebo
|
0.0001
|
< 0.0001
|
| |
≥50 % MMD-Responder – Woche 1–12
| |
Responder
|
57.6 %
|
61.4 %
|
39.3 %
| |
Differenz zu Placebo
|
18.2 %
|
22.1 %
|
| |
p-Wert vs. Placebo
|
< 0.0001
|
< 0.0001
|
| |
HIT-6 Score – Woche 12b
| |
Baseline
|
65.0
|
65.1
|
64.8
| |
Mittlere Veränderung
|
-6.2
|
-7.3
|
-4.5
| |
Differenz zu Placebo
|
-1.7
|
-2.9
|
| |
KI95%
|
(-2.8, -0.7)
|
(-3.9, -1.8)
|
| |
p-Wert vs. Placebo
|
0.0010
|
< 0.0001
|
| |
Tage pro Monat mit Verwendung von Akutmedikation – Woche 1–12a,b
| |
Baseline
|
6.6
|
6.7
|
6.2
| |
Mittlere Veränderung
|
-3.3
|
-3.5
|
-1.9
| |
Differenz zu Placebo
|
-1.2
|
-1.4
|
| |
KI95%
|
(-1.7, -0.7)
|
(-1.9, -0.9)
|
| |
p-Wert vs. Placebo
|
< 0.0001
|
< 0.0001
|
|
a Eine Baseline war der Mittelwert während der 28-tägigen Screeningphase vor Beginn der Behandlung
b Der Endpunkt für die 100-mg-Dosis war kein im Voraus festgelegter wichtiger sekundärer Endpunkt.
Patienten mit Kopfschmerz bei Medikamentenübergebrauch (MOH), die keine Opioide oder Butalbital > 4 Tage/Monat einnahmen, wurden in PROMISE 2 aufgenommen: zum Studienbeginn hatten 40.2 % der Patienten eine MOH. Bei Patienten mit chronischer Migräne mit und ohne MOH wurden zum Studienbeginn vergleichbare Abnahmen der MMD (Mittelwert für Woche 1–12) beobachtet. Die mittlere Veränderung der MMD (Woche 1–12) zu Studienbeginn betrug für Patienten mit MOH bei 300 mg -8.6, bei 100 mg -8.4 und bei Placebo -5.4 sowie für Patienten ohne MOH bei 300 mg -8.1, bei 100 mg -7.4 und bei Placebo -6.1. Die mittlere Differenz der Veränderung der MMD (Woche 1–12) gegenüber dem Studienbeginn im Vergleich zu Placebo betrug für Patienten mit MOH bei 100 mg -3.0 (-4.56; -1.52) und bei 300 mg -3.2 (95%-CI: -4.66; -1.78) sowie für Patienten ohne MOH bei 100 mg -1.5 (-2.70; -0.31) und bei 300 mg -2.4 (-3.59; -1.12).
PREVAIL: Langzeitstudie
Vyepti 300 mg wurde Patienten mit chronischer Migräne in einer offenen Studie für bis zu zwei Jahre alle 12 Wochen durch i. v.-Infusion verabreicht, mit dem primären Ziel, die Langzeitsicherheit nach wiederholten Dosen von Vyepti weiter abzuklären.
Zu den sekundären Zielen zählten die Charakterisierung der PK und der Immunogenitätsprofile von Vyepti («Unerwünschte Wirkungen») sowie die Beurteilung der therapeutischen Wirkung von Vyepti auf verschiedene von Patienten berichtete migränebezogene Ergebnisse und auf die gesundheitsbezogene Lebensqualität, einschliesslich des Kopfschmerz-Impact-Tests (HIT-6). Die Patienten waren im Mittel 41.5 Jahre alt (Bereich: 18 bis 65 Jahre), 85 % waren Frauen und 95 % waren weisser Hautfarbe. Sechsunddreissig Prozent der Patienten nahmen begleitend präventive Medikamente gegen Migräne ein. Die mittlere Anzahl Migränetage pro 28-Tages-Zeitraum in den 3 Monaten vor dem Screening lag bei 14.1 Tagen. In diese Studie wurden 128 Patienten eingeschlossen und behandelt. Insgesamt schlossen 100 Patienten (78.1 %) die Studie ab (bis Woche 104). Insgesamt zeigten die Ergebnisse dieser offenen klinischen Studie, dass die 12-wöchentliche i. v.-Infusion von Vyepti 300 mg zur präventiven Behandlung von Migräne mit einer anhaltenden und klinisch relevanten therapeutischen Wirkung einherging, die sich im Verlauf einer zweijährigen Behandlung bei Erwachsenen mit chronischer Migräne in einer Abnahme der Migräne-bezogenen Auswirkungen auf das Leben, Verbesserungen der Messwerte der gesundheitsbezogenen Lebensqualität und einer allgemeinen Verbesserung gemäss der Patient Global Impression of Change (PGIC) Skala in Bezug auf die Migräne äusserte. Das Sicherheitsprofil stimmte mit den in randomisierten, Placebo-kontrollierten Studien mit Vyepti beobachteten Sicherheitsprofilen überein.
|


