Eigenschaften/WirkungenATC-Code
A16AX18
Wirkungsmechanismus
Lumasiran ist eine doppelsträngige „small interfering RNA“ (siRNA), die den Glykolat-Oxidase (GO)-Enzymspiegel senkt, indem sie in den Hepatozyten mittels RNA-Interferenz auf die Messenger-Ribonukleinsäure (mRNA) des (für Glykolat-Oxidase kodierenden) Gens Hydroxysäureoxidase 1 (HAO1) abzielt. Verringerte GO-Enzymwerte reduzieren die Menge an verfügbarem Glyoxylat, einem Substrat für die Bildung von Oxalat. Dies führt zu einer Senkung der (erhöhten) Oxalatspiegel in Urin und Plasma, der eigentlichen Ursache für Krankheitsmanifestationen bei Patienten mit PH1. Da das GO-Enzym dem defizitären, PH1 verursachenden Alanin-Glyoxylat-Aminotransferase (AGT)-Enzym vorgeschaltet ist, ist der Wirkmechanismus von Lumasiran unabhängig von der zugrundeliegenden AGXT-Genmutation.
Pharmakodynamik
Nicht zutreffend.
Klinische Wirksamkeit
Die Wirksamkeit von Lumasiran wurde in einer randomisierten, doppelblinden, placebokontrollierten klinischen Studie an Patienten ab 6 Jahren mit PH1 (ILLUMINATE-A), in einer einarmigen klinischen Studie an Patienten unter 6 Jahren mit PH1 (ILLUMINATE-B) und in einer einarmigen klinischen Studie an pädiatrischen und erwachsenen Patienten mit PH1 und fortgeschrittener Nierenerkrankung, einschliesslich Patienten unter Hämodialyse (ILLUMINATE-C), untersucht.
ILLUMINATE-A
Insgesamt 39 Patienten mit PH1 wurden im Verhältnis 2:1 randomisiert und erhielten während der 6monatigen doppelblinden, placebokontrollierten Studienphase subkutan Lumasiran oder Placebo. Eingeschlossen wurden Patienten ab 6 Jahren mit einer geschätzten glomerulären Filtrationsrate (eGFR) ≥ 30 ml/min/1,73 m². Sie erhielten 3 Initialdosen mit 3 mg/kg Lumasiran oder Placebo einmal monatlich und anschliessend vierteljährliche Erhaltungsdosen mit 3 mg/kg Lumasiran oder Placebo (siehe «Dosierung/Anwendung»). Nach der 6monatigen doppelblinden Behandlungsphase wurden die Patienten, einschließlich der ursprünglich Placebo zugeordneten Patienten, in eine Verlängerungsphase mit Verabreichung von Lumasiran für bis zu 54 Monate aufgenommen. Die Gesamtexposition gegenüber Lumasiran betrug 165,7 Jahre.
Während der 6-monatigen doppelblinden, placebokontrollierten Phase erhielten 26 Patienten Lumasiran und 13 Placebo. Das mittlere Alter der Patienten bei der ersten Dosis betrug 14,9 Jahre (Bereich von 6,1 bis 61,0 Jahre). 66,7 % der Patienten waren männlich und 76,9 % waren weiss. Die mediane, nach Körperoberfläche (body surface area, BSA) korrigierte Oxalatausscheidung im 24-Stunden-Sammelurin betrug bei Studienbeginn 1,72 mmol/24 h/1,73 m². Der mediane Oxalat/Kreatinin-Quotient im Spontanurin betrug zu Studienbeginn 0,21 mmol/mmol und der mittlere Plasmaoxalatspiegel zu Studienbeginn 13,1 µmol/l. Insgesamt hatten 33,3 % der Patienten eine normale Nierenfunktion (eGFR ≥ 90 ml/min/1,73 m²), 48,7 % eine leichte Nierenfunktionsstörung (eGFR zwischen 60 und < 90 ml/min/1,73 m²) und 18 % eine mittelschwere Nierenfunktionsstörung (eGFR zwischen 30 und < 60 ml/min/1,73 m²). Von den in die Studie aufgenommenen Patienten berichteten zu Studienbeginn 84,6 % über symptomatische Nierensteine und 53,8 % über Nephrokalzinose in der Vorgeschichte. Die Behandlungsarme waren bei Studienbeginn hinsichtlich Alter, Oxalatspiegel im Urin und eGFR ausgeglichen.
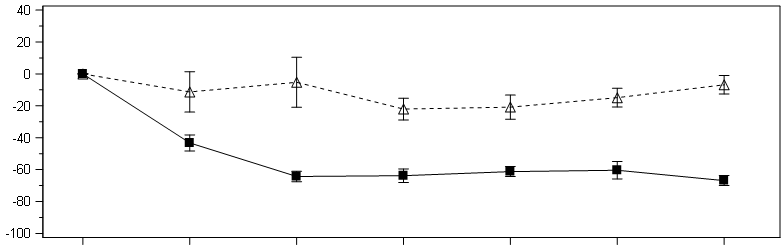
Der primäre Endpunkt war die prozentuale Verringerung der nach Körperoberfläche korrigierten Oxalatausscheidung im 24-Stunden-Sammelurin gegenüber dem Ausgangswert, gemittelt über die Monate 3–6. Lumasiran war mit einer statistisch signifikanten Verringerung des nach Körperoberfläche korrigierten Oxalats im 24-Stunden-Sammelurin von 65,4 % gegenüber 11,8 % in der Placebogruppe assoziiert. Das entspricht einer Differenz von 53,5 % (95-%-KI: 44,8; 62,3; p < 0,0001). In Übereinstimmung mit dem primären Endpunkt wurde in Monat 6 im Lumasiran-Arm eine Verringerung des Oxalat/Kreatinin-Quotienten im Spontanurin um 60,5 % beobachtet, im Vergleich zu einem Anstieg von 8,5 % im Placeboarm. Darüber hinaus kam es bei den mit Lumasiran behandelten Patienten zu einer raschen und anhaltenden Verringerung des nach Körperoberfläche korrigierten Oxalats im 24-Stunden-Sammelurin, wie in Abbildung 1 dargestellt.
Abbildung 1: ILLUMINATE-A: Prozentuale Veränderung des nach Körperoberfläche korrigierten Oxalats im 24-Stunden-Sammelurin gegenüber dem Ausgangswert nach Monaten (6-monatige, doppelblinde, placebokontrollierte Phase)
|
| |
Prozentuale Veränderung des nach Körperoberfläche korrigierten Oxalats im 24-Stunden-Sammelurin
(mmol/24 h/1,73 m²) gegenüber dem Ausgangswert
|
|
| |
|
BL
|
M1
|
M2
|
M3
|
M4
|
M5
|
M6
| |
| |
Studientermin
| |
|
Behandlungsgruppe
|
—— Lumasiran
|
—— Placebo
| |
Anzahl Patienten:
| |
|
N =
|
26
|
24
|
26
|
24
|
23
|
25
|
25
| |

|
N =
|
13
|
13
|
12
|
13
|
13
|
13
|
13
| |
|
Abkürzungen: BL = Ausgangswert (Baseline), , M = Monat, SEM = Standardfehler des Mittelwerts (Standard Error of Mean).
Die Ergebnisse werden als Mittelwert (± SEM) der prozentualen Veränderung gegenüber dem Ausgangswert dargestellt.
Bis Monat 6 erreichte ein im Vergleich zu den mit Placebo behandelten Patienten höherer Anteil der mit Lumasiran behandelten Patienten normale oder annähernd normale Werte des nach Körperoberfläche korrigierten Oxalats im 24-Stunden-Sammelurin (≤ 1,5 × ULN), wie in Tabelle 3 dargestellt.
Tabelle 3: ILLUMINATE-A: Ergebnisse zum sekundären Endpunkt der 6monatigen placebokontrollierten Doppelblindphase
|
Endpunkte
|
Lumasiran
(N = 26)
|
Placebo
(N = 13)
|
Behandlungsdifferenz
(95-%-KI)
|
p-Wert
| |
Anteil Patienten mit Oxalatspiegeln im 24-Stunden-Sammelurin ≤ ULN‡
|
0,52 (0,31; 0,72)§
|
0 (0; 0,25)§
|
0,52 (0,23; 0,70)¶
|
0,001#
| |
Anteil Patienten mit Oxalatspiegeln im 24-Stunden-Sammelurin von ≤ 1,5 × ULN‡
|
0,84 (0,64; 0,95)§
|
0 (0; 0,25)§
|
0,84 (0,55; 0,94)¶
|
0,0001#
| |
Prozentuale Verringerung des Oxalats im Plasma gegenüber Ausgangswert*Þ
|
39,8 (2,9)†
|
0,3 (4,3)†
|
39,5 (28,9; 50,1)
|
< 0,0001
|
Abkürzungen: ULN = obere Normgrenze (Upper Limit of Normal), SEM = Standardfehler des Mittelwerts (Standard Error of Mean)
Ergebnisse basierend auf Flüssigchromatographie-Tandem-Massenspektrometrie-Test (LC-MS/MS).
* Schätzung basierend auf Kleinste-Quadrate-Mittelwert der prozentualen Verringerung in Monat 3, 4, 5 und 6 unter Verwendung eines gemischten Modells für wiederholte Messungen.
† Kleinste-Quadrate (least squares, LS)-Mittelwert (SEM).
‡ ULN = 0,514 mmol/24 h/1,73 m² für nach Körperoberfläche korrigiertes Oxalat im 24-Stunden-Sammelurin.
§ 95-%-KI basierend auf exaktem Clopper-Pearson-Intervall.
¶ Berechnet mittels Newcombe-Methode basierend auf Wilson-Score-Intervallen.
# p-Wert basierend auf Cochran-Mantel-Haenszel-Test mit Stratifizierung gemäss nach Körperoberfläche korrigiertem Ausgangswert des Oxalats im 24-Stunden-Sammelurin (≤ 1,70 vs. > 1,70 mmol/24 h/1,73 m²).
Þ Auswertung bei 23 Lumasiran- und 10 Placebo-Patienten mit Ausgangswerten, die eine Verringerung zuliessen.
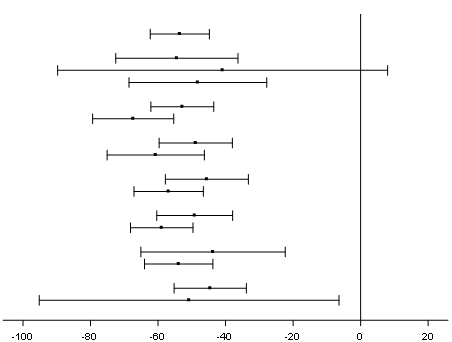
Die Verringerung des nach Körperoberfläche korrigierten Oxalats im 24-Stunden-Sammelurin gegenüber dem Ausgangswert im Vergleich zu Placebo war bei den mit Lumasiran behandelten PH1-Patienten in allen vorspezifizierten Untergruppen ähnlich, einschliesslich Alter, Geschlecht, ethnischer Herkunft, Nierenfunktionsstörung, Anwendung von Pyridoxin (Vitamin B6) bei Studienbeginn und symptomatischer Nierenstein-Ereignisse in der Anamnese (Abbildung 2).
Abbildung 2: ILLUMINATE-A: Prozentuale Veränderung des nach Körperoberfläche korrigierten Oxalats im 24-Stunden-Sammelurin gegenüber dem Ausgangswert, Untergruppenanalyse
|
|
|
|
| |
Untergruppe
|
Lumasiran – Placebo
|
Lumasiran
|
Placebo
| |
|
|
|
(N)
|
(N)
| |
|
|
| |
Gesamt
|
26
|
13
| |
Alter beim Screening
|
|
| |
6 bis < 12 Jahre
|
9
|
7
| |
12 bis < 18 Jahre
|
5
|
1
| |
≥ 18 Jahre
|
12
|
5
| |
Geschlecht
|
|
| |
Männlich
|
18
|
8
| |
Weiblich
|
8
|
5
| |
Ethnische Herkunft
|
|
| |
Weiß
|
21
|
9
| |
Nicht-Weiß
|
5
|
4
| |
Pyridoxin-Anwendung bei Studienbeginn
|
|
| |
Ja
|
13
|
9
| |
Nein
|
13
|
4
| |
Nach Körperoberfläche korrigierter Oxalat-Ausgangswert im 24-Stunden-Sammelurin
|
|
| |
≤ 1,70 mmol/24 h/1,73 m²
|
11
|
7
| |
> 1,70 mmol/24 h/1,73 m²
|
15
|
6
| |
Ausgangswert eGFR
|
|
| |
< 60 ml/min/1,73 m²
|
4
|
3
| |
≥ 60 ml/min/1,73 m²
|
22
|
10
| |
Vorgeschichte symptomatischer Nierenstein-Ereignisse im Verlauf des gesamten Lebens
|
|
| |
Ja
|
23
|
10
| |
Nein
|
3
|
3
| |
|
Begünstigt Lumasiran
|
Begünstigt Placebo
|
| |
|
|
|
|
Die in der Doppelblindphase beobachtete Verringerung der Oxalatkonzentration blieb bei fortdauernder Behandlung mit Lumasiran während der Verlängerungsphase der Studie über bis zu 6024 Monate erhalten. eGFR, und Nierenstein-Ereignisse (berichtet nach Ereignissen pro Personenjahr) und medulläre Nephrokalzinose wurden über die 6-monatigen Doppelblind- und Verlängerungsphasen während insgesamt bis zu 6024 Monaten beurteilt. Die eGFR blieb bei den mit Lumasiran behandelten Patienten stabil. Die Rate der mittleren jährlichen Veränderung gegenüber dem Ausgangswert während der bis zu 60-monatigen Behandlung mit Lumasiran betrug 0,63 ml/min/1,73 m2/Jahr.
Die Rate der Nierenstein-Ereignisse pro Personenjahr bei mit Lumasiran behandelten Patienten, die zu Lumarisan und Placebo randomisiert wurden in ILLUMINATE A, ist in Tabelle 4 aufgeführt.
Tabelle 4: Rate der Nierenstein-Ereignisse pro Personenjahr in der Lumasiran- und Placebo-Gruppe
|
Zeitraum
|
Lumasiran
Rate (95-%-KI)
|
Placebo
Rate (95-%-KCI)
| |
12 Monate vor der Einwilligung
|
3,19 (2,57; 3,96)
|
0,54 (0,26; 1,13)
| |
6-monatige Doppelblindphase
|
1,09 (0,63; 1,88)
|
0,66 (0,25; 1,76)
|
Während der verlängerten offenen Behandlung mit Lumasiran für bis zu 60 Monate betrug die Raten von Nierensteinereignissen 0,49 pro Personenjahr. 53,8 % der Patienten hatten keine Nierensteinereignisse.
Durch Nieren-Ultraschall beurteilte medulläre Nephrokalzinose-Ergebnisse von Monat 6 im Vergleich zum Ausgangswert sind in Tabelle 5 aufgeführt.
Tabelle 5: ILLUMINATE-A: Patienten mit medullärer Nephrokalzinose in Monat Doppelblinder, placebokontrollierter Zeitraum im Vergleich zum Ausgangswert*
|
Zeitpunkt
|
Behandlung
(n)
|
Verbesserung
|
Unverändert
|
Verschlechterung
| |
Monat 6
|
Lumasiran
(n=223)
|
3
|
19
|
0
| |
Placebo
(n=12)
|
0
|
11
|
1
|
* Patienten mit Nieren-Ultraschall an der Baseline und am entsprechenden Zeitpunkt wurden beurteilt.
Die Beurteilung der medullären Nephrokalzinose wurde nur bei einem Teil der Studienpopulation vorgenommen (17/26 Lumasiran-/Lumasiran-Patienten und 6/13 Placebo-/Lumarisan-Patienten wurden zu Studienbeginn sowie am Ende der 54-monatigen Verlängerungsphase untersucht). In dieser Subpopulation war ein allgemeiner Trend zu einer Besserung im zeitlichen Verlauf nachzuweisen.
ILLUMINATE-B
Insgesamt 18 Patienten wurden in eine laufende, multizentrische, einarmige Studie an PH1-Patienten (ILLUMINATE-B) aufgenommen und mit Lumasiran behandelt. Eingeschlossen wurden Patienten unter 6 Jahren mit einer eGFR > 45 ml/min/1,73 m2 bei Patienten ab einem Alter von 12 Monaten und normalem Serumkreatinin bei Patienten jünger als 12 Monate. In der primären Interimsanalyse nach 6 Monaten, bei der ersten Dosis, wogen 3 Patienten weniger als 10 kg, 12 Patienten 10 bis unter 20 kg und 3 Patienten mindestens 20 kg. Das mediane Alter der Patienten bei der ersten Dosis betrug 51,4 Monate (Bereich von 4,0 bis 74,0 Monate). 55,6 % der Patienten waren weiblich, und 88,9 % waren weiss. Der mediane Oxalat/Kreatinin-Quotient im Spontanurin betrug zu Studienbeginn 0,47 mmol/mmol.
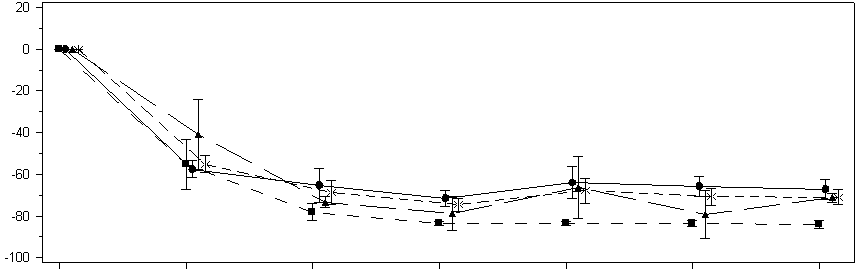
In Monat 6 erreichten mit Lumasiran behandelte Patienten eine Reduktion von 72,0 % (95-%-KI: 66,4; 77,5) des Oxalat/Kreatinin-Quotienten im Spontanurin gegenüber dem Ausgangswert (gemittelt über die Monate 3 bis 6), dem primären Endpunkt der Studie. Lumasiran wurde mit einer raschen und anhaltenden Verringerung des Oxalat/Kreatinin-Quotienten im Spontanurin (Abbildung 43) assoziiert, die in allen Gewichtsuntergruppen ähnlich ausfiel. Die prozentuale Verringerung der Oxalatausscheidung im Urin blieb bei fortdauernder Behandlung mit Lumasiran bis Monat 12 erhalten und stimmte mit den Ergebnissen der Studie ILLUMINATE-A überein.
Abbildung 3: ILLUMINATE-B: Prozentuale Veränderung des Oxalat/Kreatinin-Quotienten im Spontanurin gegenüber dem Ausgangswert nach Monaten
|
| |
Prozentuale Veränderung des Oxalat/Kreatinin-Quotienten im Spontanurin
(mmol/mmol) gegenüber dem Ausgangswert
|
|
| |
|
BL
|
M1
|
M2
|
M3
|
M4
|
M5
|
M6
| |
|
Termin
| |
|
Anfängliche Gewichtsgruppe in ILLUMINATE-B
|
- – -- – - < 10 kg
|
-●- 10 bis < 20 kg
|
– –▲– – ≥ 20 kg
|
---------- alle mit Lumasiran behandelten Patienten
| |
Anzahl Patienten:
| |
|
N =
|
3
|
3
|
3
|
3
|
3
|
3
|
3
| |
●
|
N =
|
12
|
12
|
12
|
12
|
12
|
12
|
12
| |
▲
|
N =
|
3
|
3
|
3
|
3
|
3
|
3
|
3
| |

|
N =
|
18
|
18
|
18
|
18
|
18
|
18
|
18
| |
|
In Monat 6 erreichten neun von 18 Patienten nahezu eine Normalisierung (≤ 1,5 × ULN), darunter 1 Patient, der eine Normalisierung (≤ ULN) des Oxalat/Kreatinin-Quotienten im Spontanurin erreicht hatte. An Monat 12 erreichten zehn von 18 Patienten nahezu eine Normalisierung (≤ 1,5 × ULN), darunter 2 Patienten, die eine Normalisierung (≤ ULN) des Oxalat/Kreatinin-Quotienten im Spontanurin erreicht hatten.
Darüber hinaus wurde von Studienbeginn bis Monat 6 (Durchschnitt aus Monat 3 bis Monat 6) eine mittlere Verringerung des Oxalats im Plasma von 31,7 % (95 %-KI: 23,9; 39,5) beobachtet. Während der primären Analysephase beobachtete verringerte Plasma-Oxalat-Spiegel blieben bei fortgeführter Behandlung mit Lumasiran erhalten. Die eGFR blieb bei allen Patienten bei fortgeführter Behandlung stabil.
Die Rate der Nierenstein-Ereignisse pro Personenjahr, die in den 12 Monaten vor der Einwilligung und während der 6monatigen primären Analysephase berichtet wurden, betrug 0,24 (95-%-KI: 0,09; 0,63), respektive 0,24 (95-%-KI: 0,06; 0,96). Die Ereignisrate von Monat 6 bis Monat 12 betrug 0,12 (95-%-KI: 0,02; 0,84).
Durch Nieren-Ultraschall beurteilte medulläre Nephrokalzinose-Ergebnisse in Monat 6 und Monat 12 verglichen mit dem Ausgangswert sind in Tabelle 6 aufgeführt.
Tabelle 6: ILLUMINATE-B: Patienten mit medullärer Nephrokalzinose in Monat 6 und Monat 12 verglichen mit dem Ausgangswert*
|
Zeitpunkt
|
Verbesserung (n)
|
Unverändert
|
Verschlechterung
| |
Monat 6
(n=18)
|
8
|
10
|
0
| |
Monat 12
(n=17)
|
11
|
6
|
0
|
* Patienten mit Nieren-Ultraschall an der Baseline und zu den relevanten Zeitpunkten wurden beurteilt.
ILLUMINATE-C
Gesamt wurden 21 Patienten mit PH1 und fortgeschrittener Nierenerkrankung (eGFR ≤ 45 ml/min/1,73 m2 bei Patienten im Alter von mindestens 12 Monaten und mit erhöhtem Kreatinin im Serum bei Patienten unter 12 Monaten), einschließlich Patienten unter Hämodialyse, in eine laufende multizentrische einarmige Studie aufgenommen und mit Lumasiran behandelt. ILLUMINATE-C umfasste 2 Kohorten: In Kohorte A befanden sich 6 Patienten, die bei Aufnahme in die Studie keine Dialyse benötigten, und in Kohorte B befanden sich 15 Patienten, die dauerhaft mit Hämodialyse behandelt wurden. Die Patienten erhielten die empfohlene Dosierung von Lumarsiran basierend auf ihrem Körpergewicht (siehe «Dosierung/Anwendung»).
Das mittlere Alter der Patienten zum Zeitpunkt der ersten Dosis betrug 8,9 Jahre (Bereich 0 bis 59 Jahre), 57,1 % waren männlich und 76,2 % waren weiß. Bei Patienten in Kohorte A betrug der mittlere Plasma-Oxalat-Spiegel 57,94 µmol/l. Bei Patienten in Kohorte B betrug der mittlere Plasma-Oxalat-Spiegel 103,65 µmol/l.
Primärer Endpunkt der Studie war die prozentuale Veränderung des Plasma-Oxalats von der Baseline zu Monat 6 (Durchschnitt von Monat 3 bis Monat 6) für Kohorte A (N=6) und die prozentuale Veränderung des Plasma-Oxalats vor der Dialyse von der Baseline bis Monat 6 (Durchschnitt von Monat 3 bis Monat 6) für Kohorte B (N=15).
Während der 6monatigen primären Analysephase wurde bei Patienten in beiden Kohorten bereits im ersten Monat eine Verringerung des Plasma-Oxalats beobachtet. Die prozentuale Veränderung des Plasma-Oxalat-Spiegels von der Baseline bis Monat 6 (Durchschnitt von Monat 3 bis Monat 6) war für Kohorte A eine Veränderung des LS-Mittelwerts von -33,3 % (95-%-KI: -81,82, 15,16) und für Kohorte B eine Veränderung des LS-Mittelwerts von 42,4 % (95-%-KI: -50,71, -34,15).
Abbildung 4: ILLUMINATE-C: Prozentuale Veränderung des Plasma-Oxalats (µmol/l) gegenüber dem Ausgangswert zu jedem Termin während der primären Analysephase
Die Ergebnisse werden als Mittelwert (± SEM) der prozentualen Veränderung gegenüber dem Ausgangswert dargestellt.
Abkürzungen: BL = Ausgangswert (Baseline), M = Monat, SEM = Standardfehler des Mittelwerts (Standard Error of Mean).
Für Kohorte A ist der Ausgangswert definiert als Mittelwert aller Plasma-Oxalat-Proben, die vor der ersten Dosis Lumasiran entnommen wurden. Für Kohorte B ist der Ausgangswert definiert als die letzten vier Plasma-Oxalat-Proben vor Dialyse, die vor der ersten Dosis Lumasiran entnommen wurden. In Kohorte B werden nur Proben vor der Dialyse entnommene Proben verwendet.
In Kohorte A betrug die mittlere (SD) eGFR 19,85 (9,6) ml/min/1,73 m2 bei Baseline und 16,43 (9,8) ml/min/1,73 m2 in Monat 6.
Die Rate der Nierenstein-Ereignisse pro Personenjahr, die für Kohorte A in den 12 Monaten vor der Einwilligung und während der 6monatigen primären Analysephase berichtet wurden, betrug 3,20 (95-%-KI: 1,96; 5,22), respektive 1,48 (95-%-KI: 0,55; 3,92).
Pädiatrie
Swissmedic hat für dieses Arzneimittel eine Freistellung von der Verpflichtung zur Vorlage von Ergebnissen zu Studien in allen pädiatrischen Altersklassen bei der Behandlung von AHP anerkannt.
|



