ZusammensetzungWirkstoffe
Antigenum F praefusionis stabilitum RSV subgrupi A1,2, antigenum F praefusionis stabilitum RSV subgrupi B1,2.
1in der Präfusionskonformation stabilisiertes Glykoprotein F.
2aus gentechnisch veränderten CHO (Chinese Hamster Ovary)-Zellen hergestellt.
Hilfsstoffe
Trometamolum, trometamoli hydrochloridum, saccharum, mannitolum, polysorbatum 80, natrii chloridum (corresp. 0.43 mg Natrium pro Dosis), acidum hydrochloridum (q.s. ad pH), aqua ad iniectabile.
Indikationen/AnwendungsmöglichkeitenAbrysvo wird angewendet:
·Zum passiven Schutz von Säuglingen ab der Geburt bis zum Alter von 6 Monaten vor Erkrankungen der unteren Atemwege, die durch das Respiratorische Synzytial-Virus (RSV) verursacht werden, nach Immunisierung von Schwangeren im Gestationsalter von 32 0/7 bis und mit 36 0/7 Schwangerschaftswochen (siehe «Warnhinweise und Vorsichtsmassnahmen» und «Eigenschaften/Wirkungen»).
·Zur aktiven Immunisierung zur Prävention von durch RSV verursachten Erkrankungen der unteren Atemwege von:
·Erwachsenen im Alter von 60 Jahren und älter.
·Erwachsenen zwischen 18-59 Jahren, die ein erhöhtes Risiko für eine durch RSV verursachte Erkrankung der unteren Atemwege haben.
Die Anwendung dieses Impfstoffs sollte gemäss offiziellen Empfehlungen erfolgen.
Dosierung/AnwendungSchwangere Personen
Eine Einzeldosis von 0.5 ml wird Schwangeren im Gestationsalter von 32 0/7 bis und mit 36 0/7 Schwangerschaftswochen verabreicht (siehe «Warnhinweise und Vorsichtsmassnahmen» und «Eigenschaften/Wirkungen»).
Die Notwendigkeit einer erneuten Impfung bei nachfolgenden Schwangerschaften wurde nicht nachgewiesen.
Personen ab einem Alter von 18 Jahren
Es wird eine Einzeldosis zu 0.5 ml verabreicht.
Die Notwendigkeit einer erneuten Impfung wurde nicht nachgewiesen.
Pädiatrische Population
Die Sicherheit und Wirksamkeit von Abrysvo bei Kindern (von der Geburt bis zum Alter von unter 18 Jahren) sind bisher nicht erwiesen. Es liegen sehr begrenzte Daten zu schwangeren Jugendlichen und deren Säuglingen vor (siehe «Eigenschaften/Wirkungen»).
Art der Anwendung
Abrysvo ist für die intramuskuläre Injektion in den Deltamuskel des Oberarms bestimmt.
Der Impfstoff darf nicht mit anderen Impfstoffen oder Arzneimitteln gemischt werden.
Hinweise zur Rekonstitution und Handhabung des Arzneimittels vor der Anwendung, siehe «Hinweise für die Handhabung».
Rückverfolgbarkeit
Um die Rückverfolgbarkeit von biotechnologisch hergestellten Arzneimitteln sicherzustellen, wird empfohlen, Handelsname und Chargennummer bei jeder Impfung zu dokumentieren.
KontraindikationenÜberempfindlichkeit gegenüber den Wirkstoffen oder einem der Hilfsstoffe (siehe «Zusammensetzung»).
Warnhinweise und VorsichtsmassnahmenDie Ergebnisse einer Post-Marketing-Beobachtungsstudie weisen auf ein erhöhtes Risiko für das Guillain-Barré-Syndrom innerhalb von 42 Tagen nach der Impfung mit Abrysvo hin (siehe Rubrik «Unerwünschte Wirkungen»).
Überempfindlichkeit und Anaphylaxie
Für den Fall einer anaphylaktischen Reaktion nach Verabreichung des Impfstoffs sollten immer eine entsprechende medizinische Versorgung und Überwachung bereitstehen.
Potenzielles Risiko von Frühgeburten
In zwei klinischen Studien an schwangeren Frauen wurde ein numerisches Ungleichgewicht im Vergleich zu Placebo in Bezug auf Frühgeburten bei Frauen festgestellt, die Abrysvo erhalten hatten. Die verfügbaren Daten reichen nicht aus, um einen Kausalzusammenhang zwischen einer Frühgeburtlichkeit und Abrysvo herzustellen oder auszuschliessen. Um das potenzielle Risiko einer Frühgeburt bei der Anwendung von Abrysvo vor Erreichen eines Gestationsalters von 32 Wochen zu vermeiden, sollte Abrysvo bei Schwangeren wie angegeben im Gestationsalter von 32 0/7 bis und mit 36 0/7 Schwangerschaftswochen verabreicht werden. Schwangere Frauen mit einem erhöhten Risiko für eine Frühgeburt waren im Allgemeinen von klinischen Studien mit Abrysvo ausgeschlossen (siehe «Schwangerschaft, Stillzeit» und «Unerwünschte Wirkungen»).
Angstbedingte Reaktionen
Angstbedingte Reaktionen, einschliesslich vasovagale Reaktionen (Synkope), Hyperventilation oder stressbedingte Reaktionen können im Zusammenhang mit der Impfung als psychogene Reaktion auf die Injektion mit einer Nadel auftreten. Es ist wichtig, dass Vorkehrungen getroffen werden, um Verletzungen durch eine Ohnmacht zu vermeiden.
Gleichzeitige Erkrankung
Die Impfung sollte bei Personen mit einer akuten fieberhaften Erkrankung verschoben werden. Das Vorliegen einer leichten Infektion, wie z.B. einer Erkältung, sollte jedoch nicht zum Aufschieben der Impfung führen.
Thrombozytopenie und Gerinnungsstörungen
Abrysvo ist bei Personen mit Thrombozytopenie oder einer Gerinnungsstörung mit Vorsicht zu verabreichen, da bei diesen Personen nach intramuskulärer Injektion Blutungen oder Blutergüsse auftreten können.
Immungeschwächte Personen
Immungeschwächte Personen, einschliesslich Personen unter Therapie mit Immunsuppressiva, können eine verminderte Immunantwort auf Abrysvo haben. Verfügbare Daten finden sich in den Rubriken «Unerwünschte Wirkungen» und «Eigenschaften/Wirkungen».
Personen vor einem Gestationsalter von 24 Schwangerschaftswochen
Abrysvo wurde bei schwangeren Personen, welche ein Gestationsalter von 24 Wochen noch nicht erreicht haben, nicht untersucht.
Einschränkungen der Effektivität des Impfstoffs
Wie bei jedem Impfstoff wird möglicherweise nicht bei allen Geimpften eine schützende Immunantwort erzielt.
Hilfsstoffe von besonderem Interesse
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro 0.5 ml Dosis, d.h. es ist nahezu «natriumfrei».
InteraktionenZeitgleiche Gabe mit anderen Impfstoffen
In einer randomisierten Studie mit Erwachsenen von 65 Jahren und älter (N=1'403, randomisiert 1:1) wurde die gleichzeitige Verabreichung von Abrysvo mit einem saisonalen Influenza-Impfstoff (QIV, Oberflächenantigen, inaktiviert, adjuvantiert) untersucht. Die Kriterien für die Nichtunterlegenheit der Immunantwort bei der gleichzeitigen Verabreichung gegenüber der getrennten Verabreichung wurden erfüllt. Bei gleichzeitiger Verabreichung von Abrysvo und Grippeimpfstoff wurden jedoch numerisch niedrigere RSV-A und RSV-B neutralisierende Antikörpertiter und numerisch niedrigere Influenza A und B Hämagglutinationshemmungs (HAH)-Antikörpertiter beobachtet als bei getrennter Verabreichung. Die klinische Relevanz dieser Beobachtungen ist nicht bekannt.
In einer randomisierten Studie mit Erwachsenen von 65 Jahren und älter wurde Abrysvo und ein bivalenter Original/Omicron BA.4/BA.5 COVID-19 mRNA Impfstoff mit oder ohne gleichzeitige Verabreichung eines hochdosierten, quadrivalenten Influenza-Impfstoffs untersucht. Die vordefinierten Kriterien für die Nichtunterlegenheit hinsichtlich der RSV-A und RSV-B neutralisierenden Antikörpertiter und der Antikörpertiter gegen die SARS-CoV-2-Varianten Omicron BA.4/BA.5 als auch gegen den Referenzstamm, sowohl der vier stammspezifischen HAH Antikörpertiter wurden erfüllt. Bezüglich lokaler und systemischer Reaktionen nach gleichzeitiger Verabreichung siehe «Unerwünschte Wirkungen».
Die gleichzeitige Gabe von Abrysvo mit einem Tetanus-Diphterie-azellulärem Pertussis-Impfstoff (Tdap) wurde bei gesunden, nicht schwangeren Frauen (N=141) im Alter von 18-49 Jahren untersucht. Es gab keine Sicherheitsbedenken in der untersuchten Population, wenn Abrysvo gleichzeitig mit Tdap verabreicht wurde. Bei gleichzeitiger Verabreichung waren die Immunantworten auf RSV-A, RSV-B, Diphterie und Tetanus denen bei getrennter Verabreichung nicht unterlegen. Die Antworten auf die Pertussis-Komponenten waren bei gleichzeitiger Verabreichung allerdings niedriger als bei getrennter Verabreichung; eine Nichtunterlegenheit konnte für keines der azellulären Pertussis-Antigene (Pertussis-Toxoid [PT], filamentöses Hämagglutinin [FHA] und Pertactin [PRN]) nachgewiesen werden, da die untere Grenze des 95%-KI für die GMC-Verhältnisse zwischen der Gruppe mit gleichzeitiger Verabreichung und der Gruppe mit getrennter Verabreichung nicht über 0.67 lag. Die untere Grenze des 95%-KI für das GMC-Verhältnis betrug für PT 0.64, für FHA 0.50 und für PRN 0.48. Die klinische Relevanz dieser Beobachtung ist nicht bekannt.
Zwischen der Verabreichung von Abrysvo und einem Tetanus-Diphterie-azellulärem Pertussis-Impfstoff (Tdap) wird ein Abstand von mindestens zwei Wochen empfohlen.
Daten zur gleichzeitigen Verabreichung von Abrysvo und anderen Impfstoffen als den oben genannten liegen nicht vor.
Unterschiedliche injizierbare Impfstoffe müssen immer an unterschiedlichen Stellen verabreicht werden.
Abrysvo darf nicht mit anderen Impfstoffen/Arzneimitteln in derselben Spritze gemischt werden.
Bei schwangeren Frauen wurde die gleichzeitige Verabreichung von Abrysvo mit Tdap, COVID-19 mRNA Impfstoffen oder Influenza-Impfstoffen nicht untersucht.
Schwangerschaft, StillzeitSchwangerschaft
Daten bei schwangeren Frauen (mehr als 4'000 Schwangerschaftsergebnisse nach Exposition) deuten nicht auf ein Fehlbildungsrisiko oder eine fetale/neonatale Toxizität hin.
Ergebnisse tierexperimenteller Studien mit Abrysvo ergaben keine Hinweise auf direkte oder indirekte gesundheitsschädliche Wirkungen in Bezug auf eine Reproduktionstoxizität (siehe «Präklinische Daten»).
Die in einer Phase 3-Studie (Studie C3671008) bei Müttern innerhalb von 1 Monat nach der Impfung beobachteten unerwünschten Ereignisse waren in der Abrysvo-Gruppe (13.8%) mit denen in der Placebo-Gruppe (13.1%) vergleichbar. Schwerwiegende Nebenwirkungen, die bei schwangeren Frauen in der Abrysvo-Gruppe und in der Placebo-Gruppe auftraten, waren Präeklampsie (1.8% gegenüber 1.4%), Hypertonie (0.4% gegenüber 0.2%), Schwangerschaftshypertonie (1.2% gegenüber 1.1%), vorzeitiger Blasensprung (0.4% gegenüber 0.4%), früher vorzeitiger Blasensprung (0.4% gegenüber 0.3%), mütterlicher Tod (<0.1% gegenüber 0%) und fötaler Tod (0.3% gegenüber 0.3%).
Es wurden keine Sicherheitssignale bei bis zu 24 Monate alten Säuglingen festgestellt. Die bei Säuglingen innerhalb von 1 Monat nach der Geburt aufgetretenen Häufigkeiten der unerwünschten Ereignisse waren in der Abrysvo-Gruppe (38%) mit denen in der Placebo-Gruppe (35%) vergleichbar.
Die wichtigsten in der Abrysvo-Gruppe im Vergleich zu Placebo bewerteten Geburtsereignisse umfassten Frühgeburt (207 [6%] bzw. 172 [5%]), niedriges Geburtsgewicht (186 [5%] bzw. 158 [4%]) und kongenitale Anomalien (205 [6%] bzw. 245 [7%]).
Die verfügbaren Daten reichen nicht aus, um einen Kausalzusammenhang zwischen einer Frühgeburtlichkeit und Abrysvo herzustellen oder auszuschliessen (siehe «Warnhinweise und Vorsichtsmassnahmen» und «Unerwünschte Wirkungen»).
Um ein mögliches Risiko für eine Frühgeburt zu minimieren, sollte Abrysvo schwangeren Personen im Gestationsalter von 32 0/7 bis und mit 36 0/7 Schwangerschaftswochen verabreicht werden.
Stillzeit
Es ist nicht bekannt, ob Abrysvo in die Muttermilch übergeht. Abrysvo zeigte keine schädlichen Auswirkungen auf gestillte Neugeborene von geimpften Müttern.
Fertilität
Es liegen keine Daten über die Auswirkung von Abrysvo auf die Fertilität beim Menschen vor.
Tierexperimentelle Studien ergaben keine Hinweise auf direkte oder indirekte gesundheitsschädliche Wirkungen in Bezug auf die weibliche Fertilität (siehe «Präklinische Daten»).
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von MaschinenAbrysvo hat keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
Unerwünschte WirkungenZusammenfassung des Sicherheitsprofils
Die Sicherheit der Verabreichung einer Einzeldosis Abrysvo an schwangere Frauen mit einem Gestationsalter von 24 - 36 Schwangerschaftswochen (n=3'698), Personen ab einem Alter von 60 Jahren (n=18'574) und Personen im Alter von 18 bis 59 Jahren mit hohem Risiko für durch RSV verursachte Erkrankungen der unteren Atemwege (n=453) wurde in klinischen Phase 3-Studien untersucht.
Schwangere Personen
Die am häufigsten gemeldeten Nebenwirkungen bei schwangeren Frauen mit einem Gestationsalter von 24 - 36 Schwangerschaftswochen waren Schmerzen an der Injektionsstelle (41%), Kopfschmerzen (31%) und Myalgie (27%). Die Mehrzahl der lokalen und systemischen Reaktionen bei den teilnehmenden Müttern waren leicht bis mittelschwer und klangen innerhalb von 2-3 Tagen nach dem Auftreten ab.
Personen ab einem Alter von 60 Jahren
Bei Personen ab einem Alter von 60 Jahren waren die am häufigsten gemeldeten Nebenwirkungen Schmerzen an der Injektionsstelle (11%). Die meisten Nebenwirkungen waren leicht bis mittelschwer und klangen innerhalb von 1-2 Tagen nach dem Auftreten ab.
Personen im Alter von 18 bis 59 Jahren
Basierend auf einer Studie an Personen mit erhöhtem Risiko für durch RSV verursachte Erkrankungen der unteren Atemwege, waren die am häufigsten gemeldeten Nebenwirkungen bei Personen im Alter von 18 bis 59 Jahren Schmerzen an der Injektionsstelle (35%) und Myalgie (24%). Die meisten Nebenwirkungen waren leicht bis mittelschwer und klangen innerhalb von 1-2 Tagen nach dem Auftreten ab.
Liste der unerwünschten Wirkungen
Die unerwünschten Wirkungen sind nach MedDRA-Systemorganklassen und Häufigkeit gemäss fol-gender Konvention geordnet: «sehr häufig» (≥1/10), «häufig» (≥1/100, <1/10), «gelegentlich» (≥1/1'000, <1/100), «selten» (≥1/10'000, <1/1'000), «sehr selten» (<1/10'000), «nicht bekannt» (kann aus den verfügbaren Daten nicht abgeschätzt werden).
Tabelle 1 Nebenwirkungen nach Verabreichung von Abrysvo
|
Systemorganklasse
|
Nebenwirkungen
Schwangere Personen ≤49 Jahre
|
Nebenwirkungen
Personen ≥18 Jahre
| |
Erkrankungen des Blutes und des Lymphsystems
| |
Lymphadenopathie
|
Selten
|
Selten
| |
Erkrankungen des Immunsystems
| |
Überempfindlichkeitsreaktionena
|
Selten
|
Selten
| |
Anaphylaxie
|
|
Sehr selten
| |
Erkrankungen des Nervensystems
| |
Kopfschmerzen
|
Sehr häufig (31.0%)
|
Sehr häufig (19.5%)
| |
Guillain-Barré-Syndrom
|
|
Sehr selten
| |
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
| |
Myalgie
|
Sehr häufig (26.6%)
|
Sehr häufig (16.4%)
| |
Arthralgie
|
|
Häufig
| |
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
| |
Müdigkeit
|
|
Sehr häufig (23.5%)
| |
Schmerzen an der Injektionsstelle
|
Sehr häufig (40.7%)
|
Sehr häufig (18.9%)
| |
Rötung an der Injektionsstelle
|
Häufig
|
Häufig
| |
Schwellung an der Injektionsstelle
|
Häufig
|
Häufig
| |
a
Überempfindlichkeitsreaktionen schliessen Ausschlag und Urtikaria ein.
|
Beschreibung spezifischer unerwünschter Wirkungen und Zusatzinformationen
Guillain-Barré-Syndrom
In einer Studie an Personen ab einem Alter von 60 Jahren wurden ein Fall von Guillain-Barré-Syndrom (Diagnose später zu chronischer entzündlicher demyelinisierender Polyneuropathie geändert) und ein Fall von Miller-Fisher-Syndrom berichtet, die 7 bzw. 8 Tage nach der Verabreichung von Abrysvo auftraten und nach Beurteilung des Prüfarztes mit dem verabreichten Impfstoff in Zusammenhang stehen könnten. Beide Fälle beinhalteten entweder Störfaktoren oder eine alternative Ätiologie.
Der Zusammenhang zwischen der Impfung mit Abrysvo und Guillain-Barré-Syndrom (GBS) wurde bei Personen ab einem Alter von 65 Jahren in den USA anhand von Versicherungsdaten zwischen Mai 2023 und Juli 2024 untersucht. Impfungen mit Abrysvo und potenzielle Fälle von GBS mit Hospitalisierung bei Personen, die Abrysvo erhalten hatten, wurden anhand von Verfahrens- und Medikamentencodes bzw. ICD-Codes (International Classification of Diseases) identifiziert. GBS-Diagnosen in Versicherungsdaten wurden durch Überprüfung der Krankenakten bestätigt, sofern diese verfügbar waren.
Das Risiko für GBS nach einer Impfung mit Abrysvo wurde in selbstkontrollierten Fallserienanalysen unter Verwendung eines Risikofensters von 1 bis 42 Tagen nach der Impfung und eines Kontrollfensters von 43 bis 90 Tagen nach der Impfung bewertet. Die Analysen aller GBS-Fälle auf der Grundlage von Versicherungsdaten deuten auf ein erhöhtes Risiko für GBS in den 42 Tagen nach der Impfung mit Abrysvo hin, mit einem Inzidenzratenverhältnis (GBS-Fälle im Risikofenster/Kontrollfenster) von 2.02 (95%-KI: 0.93, 4.40) und geschätzten 9 zusätzlichen GBS-Fällen pro Million verabreichter Dosen bei Personen ab einem Alter von 65 Jahren. Das Hintergrundrisiko für GBS in einer Studienpopulation beeinflusst die Schätzung zusätzlicher GBS-Fälle und kann zwischen den Studien variieren, was einen unmittelbaren Vergleich mit Schätzungen zusätzlicher GBS-Fälle aus anderen Impfstoffstudien oder Populationen ausschliesst.
Die Analysen der GBS-Diagnosen in den Versicherungsdaten wurden durch Analysen von GBS-Fällen, die durch die Überprüfung der Krankenakten bestätigt wurden, sowie durch Analysen von GBS-Fällen bei Personen, die ausschliesslich Abrysvo ohne andere gleichzeitig verabreichte Impfstoffe erhielten, unterstützt.
Frühgeburtlichkeit in klinischen Studien
In zwei klinischen Studien mit schwangeren Frauen, die in einem Gestationsalter von 24 - 36 Schwangerschaftswochen geimpft wurden, wurde ein numerisches Ungleichgewicht im Vergleich zu Placebo in Bezug auf Frühgeburten bei Frauen festgestellt, die Abrysvo erhalten hatten.
Bei Studie C3671003 handelt es sich um eine randomisierte, placebokontrollierte, beobachterverblindete Phase 2-Studie, welche die Sicherheit von zwei Dosisstufen (120 µg und 240 µg) von Abrysvo bei Verabreichung an Schwangere untersuchte. Abrysvo (120 µg) wurde 115 teilnehmenden Müttern verabreicht, und 114 Säuglinge wurden von diesen teilnehmenden Müttern geboren. In dieser Studie traten Frühgeburten bei 5.3% (6 von 114) in der Abrysvo-Gruppe und bei 2.6% (3 von 116) in der Placebogruppe auf.
In der anschliessenden Phase 3-Studie C3671008 traten Frühgeburten bei 5.7% (95%-KI: 4.9, 6.5; 207 von 3'659) in der Abrysvo-Gruppe und bei 4.7% (95%-KI: 4.1, 5.5; 172 von 3'646) in der Placebogruppe auf. Von den Frühgeborenen blieben 84 Säuglinge in der Abrysvo-Gruppe und 81 Säuglinge in der Placebo-Gruppe weiterhin hospitalisiert oder wurden als Neugeborene (bis 30 Tage nach der Geburt) erneut ins Spital eingewiesen. Die verfügbaren Daten reichen nicht aus, um einen Kausalzusammenhang zwischen einer Frühgeburtlichkeit und Abrysvo herzustellen oder auszuschliessen. Ein numerisches Ungleichgewicht in Bezug auf die Frühgeburtlichkeit wurde auch in der Untergruppe der Säuglinge von Teilnehmerinnen der Studie C3671008 beobachtet, die in einem Gestationsalter von 32 - 36 Schwangerschaftswochen geimpft wurden. Hier kam es in der Abrysvo-Gruppe bei 4.3% (71/1'667) und in der Placebo-Gruppe bei 3.7% (60/1'640) zu einer Frühgeburt (siehe «Warnhinweise und Vorsichtsmassnahmen» und «Schwangerschaft, Stillzeit»).
Spezialpopulationen
Immungeschwächte Personen ab 18 Jahren
Die Sicherheit von Abrysvo bei 203 immungeschwächten Personen ab einem Alter von 18 Jahren wurde in einer klinischen Phase-3-Studie untersucht. Alle abgefragten lokalen Reaktionen waren leicht bis mittelschwer und die meisten dauerten im Median 1–3 Tage. Nach Dosis 1 wurden tendenziell weniger lokale Reaktionen gemeldet als nach Dosis 2. Schmerzen an der Injektionsstelle waren die am häufigsten gemeldete lokale Reaktion. Die abgefragten systemischen Reaktionen waren meist leicht bis mittelschwer und die meisten dauerten im Median 1–4 Tage. Die Meldungen der systemischen Reaktionen fielen dabei nach jeder Dosis ähnlich aus. Die am häufigsten gemeldete systemische Reaktion war Ermüdung. Schwere systemische Reaktionen wurden bei 2% der Teilnehmenden im Alter von 18 bis <60 Jahren und bei 6% der Teilnehmenden im Alter von ≥60 Jahren nach einer beliebigen Dosis gemeldet.
Gleichzeitige Verabreichung mit einem COVID-19-Impfstoff oder mit einem COVID-19-Impfstoff und einem saisonalen Influenza-Impfstoff
Lokale und systemische Reaktionen, die innerhalb von 7 Tagen nach der Impfstoffverabreichung auftraten, wurden von Teilnehmern, die die gleichzeitig verabreichten Impfstoffe erhielten, häufiger gemeldet als von Teilnehmern, die nur Abrysvo erhielten. Die am häufigsten berichteten Nebenwirkungen (≥20%) in der Abrysvo- und bivalenten Original/Omicron BA.4/BA.5-COVID-19-mRNA-Impfstoff (COVID-19-Impfstoff) Gruppe (n=157), in der Gruppe mit Abrysvo mit COVID-19-Impfstoff und hochdosiertem quadrivalentem Influenza-Impfstoff (n=158) und in der Gruppe mit Abrysvo allein (n=152) waren Schmerzen an der Injektionsstelle (56.7%, 53.8% und 10.5%), Müdigkeit (38.9%, 46.8% bzw. 24.3%) und Kopfschmerzen (24.2%, 19.0% bzw. 19.1%). Andere, seltener berichtete lokale und systemische Reaktionen (10 - 15%) in der Gruppe mit Abrysvo und COVID-19-Impfstoff (n=157), in der Gruppe mit Abrysvo, COVID-19-Impfstoff und hochdosiertem quadrivalentem Influenza-Impfstoff (n=158) und in der Gruppe mit Abrysvo allein (n=152) waren Rötung (12.7%, 8.9% bzw. 2.6%), Schwellung (12.7%, 7.0% bzw. 3.3%), Schüttelfrost (10.2%, 10.8% bzw. 3.9%), Muskelschmerzen (14.0%, 14.6% bzw. 9.9%) und Gelenkschmerzen (10.2%, 9.5% bzw. 5.9%).
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
ÜberdosierungAufgrund der Verabreichung als Einzeldosis ist eine Überdosierung mit Abrysvo unwahrscheinlich.
Eine bestimmte Behandlung für eine Überdosierung mit Abrysvo ist nicht verfügbar. Im Falle einer Überdosierung sollte die Person überwacht und gegebenenfalls eine symptomatische Behandlung eingeleitet werden.
Eigenschaften/WirkungenATC-Code
J07BX05
Wirkungsmechanismus
Abrysvo enthält zwei rekombinante stabilisierte RSV-Präfusions-F-Antigene der RSV Untergruppen A und B. Das Präfusions-F-Antigen ist das primäre Ziel für neutralisierende Antikörper, die eine RSV-Infektion verhindern. Nach intramuskulärer Verabreichung lösen die Präfusions-F-Antigene eine Immunantwort aus, die vor RSV assoziierten Erkrankungen der unteren Atemwege schützt.
Bei Säuglingen von Müttern, die während der Schwangerschaft mit Abrysvo geimpft wurden, ist der Schutz vor RSV-assoziierten Erkrankungen der unteren Atemwege auf die Übertragung von RSV-neutralisierenden Antikörpern über die Plazenta zurückzuführen. Erwachsene ab einem Alter von 18 Jahren werden durch aktive Immunisierung geschützt.
Pharmakodynamik
Keine Angaben.
Klinische Wirksamkeit
Säuglinge ab der Geburt bis zu einem Alter von 6 Monaten durch aktive Immunisierung schwangerer Personen
Bei Studie C3671008 handelte es sich um eine multizentrische, randomisierte (1:1), doppelblinde, placebokontrollierte Phase 3-Studie zur Beurteilung der Wirksamkeit einer Einzeldosis Abrysvo zur Prävention RSV assoziierter Erkrankungen der unteren Atemwege bei Säuglingen, deren Mütter in einem Gestationsalter von 24 - 36 Schwangerschaftswochen geimpft worden waren.
In dieser Studie wurden 3'711 Schwangere mit unkomplizierten Einlingsschwangerschaften in die Abrysvo- und 3'709 in die Placebo-Gruppe randomisiert.
Von den schwangeren Frauen, die Abrysvo erhielten, waren 65% weiss, 20% schwarz oder afroamerikanisch und 29% hispanisch/lateinamerikanisch. Das mediane Alter lag bei 29 Jahren (Spanne: 16–45 Jahre), 0.2% der Teilnehmenden waren unter 18 Jahre alt und 4.3% unter 20 Jahre alt. Das mediane Gestationsalter bei der Impfung betrug 31 Wochen und 2 Tage (Spanne: 24 Wochen und 0 Tage bis 36 Wochen und 4 Tage). Das mediane Schwangerschaftsalter der Säuglinge bei der Geburt lag bei 39 Wochen und 1 Tag (Spanne: 27 Wochen und 3 Tage bis 43 Wochen und 6 Tage).
Die Impfstoffwirksamkeit (IW) wurde definiert als die relative Risikoreduktion für den Endpunkt in der Abrysvo-Gruppe im Vergleich zur Placebo-Gruppe bei Säuglingen, deren Mütter die zugewiesene Intervention erhalten hatten. In der Primäranalyse wurden zwei primäre Wirksamkeitsendpunkte parallel bewertet: schwere ärztlich behandelte Erkrankung der unteren Atemwege mit RSV Nachweis und ärztlich behandelte Erkrankung der unteren Atemwege mit RSV Nachweis innerhalb von 90, 120, 150 oder 180 Tagen nach der Geburt.
Eine RSV-assoziierte Erkrankung der unteren Atemwege wurde definiert als Arztbesuch mit Bestätigung einer RSV-Infektion mittels Reverse-Transkriptase-Polymerase-Kettenreaktion (RT-PCR) mit einem oder mehreren der folgenden Atemwegssymptome: schnelle Atmung (Atemfrequenz ≥60/min bei einem Alter von <2 Monaten [<60 Tage], ≥50/min bei einem Alter von ≥2 Monaten bis <12 Monaten oder ≥40/min bei einem Alter von ≥12 Monaten bis 24 Monaten), niedrige Sauerstoffsättigung (SpO2 <95%) und Einziehen des Brustkorbs beim Atmen. Eine RSV-assoziierte schwere Erkrankung der unteren Atemwege wurde als eine Erkrankung definiert, welche die RSV Kriterien für eine Erkrankung der unteren Atemwege erfüllte plus mindestens eines der folgenden Symptome: sehr schnelle Atmung (Atemfrequenz ≥70/min bei einem Alter von <2 Monaten [<60 Tage], ≥60/min bei einem Alter von ≥2 Monaten bis <12 Monaten oder ≥50/min bei einem Alter von ≥12 Monaten bis 24 Monaten), niedrige Sauerstoffsättigung (SpO2 <93%), High-flow-Sauerstoff-Supplementierung mittels Nasenbrille oder maschineller Beatmung, Behandlung auf der Intensivstation für >4 Stunden und/oder fehlende Ansprechbarkeit/Bewusstlosigkeit.
In der untersuchten Population erfüllten die Ergebnisse zur Impfstoffwirksamkeit das statistische Erfolgskriterium (die untere Grenze des KI >20%) für die Verringerung schwerer, durch RSV verursachter, ärztlich behandelter Erkrankung der unteren Atemwege zu allen Zeitpunkten innerhalb von 180 Tagen. Die Ergebnisse zur Impfstoffwirksamkeit erfüllten nicht das statistische Erfolgskriterium für die Verringerung der RSV verursachter, ärztlich behandelter Erkrankung der unteren Atemwege, jedoch wurde eine klinisch bedeutsame Wirksamkeit zu den Zeitpunkten 90 Tage bis 180 Tage nach der Geburt beobachtet.
Die Impfstoffwirksamkeit bei Säuglingen ab der Geburt bis zum Alter von 180 Tagen, deren Mütter im Gestationsalter von 32 0/7 bis und mit 36 0/7 Schwangerschaftswochen geimpft wurden, basiert auf einer Post-hoc Analyse. Die Impfstoffwirksamkeit ist in die Tabellen 2 und 3 dargestellt.
Tabelle 2 Impfstoffwirksamkeit von Abrysvo gegen schwere durch RSV verursachte, ärztlich behandelte Erkrankung der unteren Atemwege bei Säuglingen ab der Geburt bis zu einem Alter von 6 Monaten durch aktive Immunisierung der Mutter im Gestationsalter von 32 0/7 bis und mit 36 0/7 Schwangerschaftswochen – Studie C3671008a
|
Zeitraum
|
Abrysvo
Anzahl der Fälle
n=1'572b
|
Placebo
Anzahl der Fälle
n=1'539b
|
% IW
(KI)c
| |
90 Tage
|
1
|
11
|
91.1 (38.8, 99.8)
| |
180 Tage
|
6
|
25
|
76.5 (41.3, 92.1)
|
KI = Konfidenzintervall; IW = Impfstoffwirksamkeit
a Die Post-hoc deskriptive Subgruppenanalyse wurde nicht für Mehrfachvergleiche korrigiert; Ergebnisse innerhalb 90 Tagen und 180 Tagen werden dargestellt.
b auswertbare Wirksamkeitspopulation.
c 95% KI
Tabelle 3 Impfstoffwirksamkeit von Abrysvo gegen durch RSV verursachte, ärztlich behandelte Erkrankung der unteren Atemwege bei Säuglingen ab der Geburt bis zu einem Alter von 6 Monaten durch aktive Immunisierung der Mutter im Gestationsalter von 32 0/7 bis und mit 36 0/7 Schwangerschaftswochen – Studie C3671008a
|
Zeitraum
|
Abrysvo
Anzahl der Fälle
n=1'572b
|
Placebo
Anzahl der Fälle
n=1'539b
|
% IW
(KI)c
| |
90 Tage
|
14
|
21
|
34.7 (-34.6, 69.3)
| |
180 Tage
|
24
|
55
|
57.3 (29.8, 74.7)
|
KI = Konfidenzintervall; IW = Impfstoffwirksamkeit
a Die Post-hoc deskriptive Subgruppenanalyse wurde nicht für Mehrfachvergleiche korrigiert; Ergebnisse innerhalb 90 Tagen und 180 Tagen werden dargestellt.
b auswertbare Wirksamkeitspopulation.
c 95% KI
Aktive Immunisierung von Personen ab einem Alter von 18 Jahren
Klinische Wirksamkeit bei Personen ab einem Alter von 60 Jahren
Bei Studie C3671013 handelte es sich um eine multizentrische, randomisierte, doppelblinde, placebokontrollierte Phase 3-Studie zur Beurteilung der Wirksamkeit von Abrysvo zur Prävention RSV assoziierter Erkrankungen der unteren Atemwege bei Personen ab einem Alter von 60 Jahren.
Eine RSV-assoziierte Erkrankung der unteren Atemwege wurde definiert als mittels RT-PCR bestätigte RSV-Erkrankung mit mindestens 2 oder mindestens 3 der folgenden Atemwegssymptome innerhalb von 7 Tagen ab Symptombeginn und einer Dauer von mehr als 1 Tag während derselben Erkrankung: neu auftretender oder sich verschlimmernder Husten, Giemen, Sputumproduktion, Kurzatmigkeit oder Tachypnoe (≥25 Atemzüge/Minute oder 15% schnellere Atmung im Vergleich zum Ausgangswert in Ruhe).
Die Teilnehmenden wurden auf Abrysvo (n=18'487) oder Placebo (n=18'479) randomisiert (1:1). Die Aufnahme in die Studie erfolgte stratifiziert nach Alter: 60–69 Jahre (63%), 70–79 Jahre (32%) und ≥80 Jahre (6%). Personen mit stabilen chronischen Grunderkrankungen durften in die Studie aufgenommen werden, und 52% der Teilnehmenden hatten mindestens eine zuvor definierte Erkrankung; 16% der Teilnehmenden wurden mit stabilen chronischen kardiopulmonalen Erkrankungen wie Asthma (9%), chronisch obstruktiver Lungenerkrankung (7%) oder kongestiver Herzinsuffizienz (2%) in die Studie aufgenommen. Personen mit einer Immunschwäche waren von der Teilnahme ausgeschlossen.
Von den Teilnehmenden, die Abrysvo erhielten, waren 51% männlich und 80% waren weiss, 12% schwarz oder afroamerikanisch und 42% hispanisch/lateinamerikanisch. Das mediane Alter der Teilnehmenden betrug 67 Jahre (Spanne: 59–95 Jahre).
Das primäre Ziel war die Beurteilung der Impfstoffwirksamkeit (IW), definiert als die relative Risikoreduktion für eine erste Episode einer RSV-assoziierten Erkrankung der unteren Atemwege in der Abrysvo-Gruppe im Vergleich zur Placebo-Gruppe in der ersten RSV-Saison.
Am Ende der ersten RSV-Saison zeigte die Auswertung der Ergebnisse eine statistisch signifikante Wirksamkeit von Abrysvo bei der Verringerung von RSV-assoziierten Erkrankungen der unteren Atemwege mit ≥2 Symptomen und ≥3 Symptomen im Vergleich zu Placebo.
Angaben zur Impfstoffwirksamkeit am Ende der ersten RSV-Saison mit einer medianen Nachbeobachtungszeit von 7.4 Monate finden sich in Tabelle 4.
Tabelle 4 Analyse der Impfstoffwirksamkeit von Abrysvo gegen RSV-Erkrankungen der unteren Atemwege am Ende der ersten RSV-Saison und nach Subgruppea (Studie C3671013)
|
Wirksamkeitsendpunkt
|
|
Abrysvo
Anzahl der Fälle
n/N
|
Placebo
Anzahl der Fälle
n/N
|
% IW
(95%-KI)
| |
Erste RSV-Saison
| |
Erste Episode einer RSV-assoziierten Erkrankung der unteren Atemwege mit ≥2 Symptomen
|
Gesamt
|
15/18'058
|
43/18'058
|
65.1
(35.9, 82.0)
| |
Subgruppea
| |
Alter 60–69 Jahre
|
10/11'305
|
25/11'351
|
60.0 (13.8, 82.9)
| |
Alter 70–79 Jahre
|
4/5'750
|
12/5'742
|
nicht abschliessend beurteilbarb
| |
Alter ≥80 Jahre
|
1/995
|
6/981
|
nicht abschliessend beurteilbarb
| |
Mit ≥1 signifikanten Grunderkrankung
|
8/9'377
|
22/9'432
|
63.6 (15.2, 86.0)
| |
RSV-Subgruppe A
|
3/18'050
|
16/18'074
|
81.3 (34.5, 96.5)
| |
RSV-Subgruppe B
|
12/18'050
|
26/18'074
|
53.8 (5.2, 78.8)
| |
Erste Episode einer RSV-assoziierten Erkrankung der unteren Atemwege mit ≥3 Symptomen
|
Gesamt
|
2/18'058
|
18/18'076
|
88.9
(53.6, 98.7)
| |
Subgruppea
| |
Alter 60–69 Jahre
|
2/11'305
|
11/11'351
|
81.8 (16.7, 98.0)
| |
Alter 70–79 Jahre
|
0/5'750
|
4/5'742
|
nicht abschliessend beurteilbarb
| |
Alter ≥80 Jahre
|
0/995
|
3/981
|
nicht abschliessend beurteilbarb
| |
Mit ≥1 signifikanten Grunderkrankung
|
2/9'377
|
11/9'432
|
81.8 (16.7, 98.0)
| |
RSV-Subgruppe A
|
1/18'050
|
5/18'074
|
80.0 (-78.7, 99.6)
| |
RSV-Subgruppe B
|
1/18'050
|
12/18'074
|
91.7 (43.7, 99.8)
|
KI = Konfidenzintervall, RSV = Respiratorisches Synzytial-Virus, IW = Impfstoffwirksamkeit.
a Explorative Analyse.
b Aufgrund der geringeren Gesamtzahl der Fälle ist die Impfstoffwirksamkeit nicht abschliessend beurteilbar.
Die Impfstoffwirksamkeit am Ende der zweiten Saison und die kombinierten Daten über beide RSV-Saisons mit einer medianen Nachbeobachtungszeit von 16.4 Monaten hinweg auf der Grundlage explorativer Analysen sind in Tabelle 5 dargestellt.
Tabelle 5 Analyse der Impfstoffwirksamkeit von Abrysvo gegen RSV-Erkrankungen der unteren Atemwege am Ende der zweiten RSV-Saison und über beide RSV-Saisons und nach Subgruppe (Studie C3671013)
|
Wirksamkeitsendpunkt
|
|
Abrysvo
Anzahl der Fälle
n/N
|
Placebo
Anzahl der Fälle
n/N
|
IW (%)
(95%-KI)
| |
Zweite RSV-Saison
| |
Erste Episode einer RSV-assoziierten Erkrankung der unteren Atemwege mit ≥2 Symptomen
|
Gesamt
|
39/16'164
|
88/16'059
|
55.7
(34.7, 70.4)
| |
Subgruppe
| |
Alter 60–69 Jahre
|
24/10'222
|
55/10'196
|
56.4 (28.3, 74.2)
| |
Alter 70–79 Jahre
|
11/5'111
|
28/5'056
|
60.7 (18.6, 82.4)
| |
Alter ≥80 Jahre
|
4/831
|
5/807
|
nicht abschliessend beurteilbarb
| |
Mit ≥1 signifikanten Grunderkrankung
|
28/8'415
|
49/8'399
|
42.9 (7.3, 65.4)
| |
RSV-Subgruppe A
|
24/16'164
|
64/16'059
|
62.5 (39.2, 77.6)
| |
RSV-Subgruppe B
|
14/16'164
|
26/16'059
|
46.2 (-7.0, 74.0)
| |
Erste Episode einer RSV-assoziierten Erkrankung der unteren Atemwege mit ≥3 Symptomen
|
Gesamt
|
8/16'164
|
36/16'059
|
77.8
(51.4, 91.1)
| |
Subgruppe
| |
Alter 60–69 Jahre
|
5/10'222
|
27/10'196
|
81.5 (51.2, 94.4)
| |
Alter 70–79 Jahre
|
3/5'111
|
7/5'056
|
nicht abschliessend beurteilbarb
| |
Alter ≥80 Jahre
|
0/831
|
2/807
|
nicht abschliessend beurteilbarb
| |
Mit ≥1 signifikanten Grunderkrankung
|
7/8'415
|
23/8'399
|
69.6 (26.7, 89.0)
| |
RSV-Subgruppe A
|
5/16'164
|
26/16'059
|
80.8 (49.1, 94.2)
| |
RSV-Subgruppe B
|
2/16'164
|
10/16'059
|
80.0 (6.1, 97.9)
| |
Über 2 RSV-Saisons hinwega
| |
Erste Episode einer RSV-assoziierten Erkrankung der unteren Atemwege mit ≥2 Symptomen
|
Gesamt
|
54/18'050
|
131/18'074
|
58.8
(43.0, 70.6)
| |
Subgruppe
| |
Alter 60–69 Jahre
|
34/11'305
|
80/11'351
|
57.5 (35.8, 72.4)
| |
Alter 70–79 Jahre
|
15/5'750
|
40/5'742
|
62.5 (30.6, 80.8)
| |
Alter ≥80 Jahre
|
5/995
|
11/981
|
nicht abschliessend beurteilbarb
| |
Mit ≥1 signifikanten Grunderkrankung
|
36/9'387
|
71/9'448
|
49.3 (23.2, 67.0)
| |
RSV-Subgruppe A
|
27/18'050
|
80/18'074
|
66.3 (47.2, 79.0)
| |
RSV-Subgruppe B
|
26/18'050
|
52/18'074
|
50.0 (18.5, 70.0)
| |
Erste Episode einer RSV-assoziierten Erkrankung der unteren Atemwege mit ≥3 Symptomen
|
Gesamt
|
10/18'050
|
54/18'074
|
81.5
(63.3, 91.6)
| |
Subgruppe
| |
Alter 60–69 Jahre
|
7/11'305
|
38/11'351
|
81.6 (58.2, 93.1)
| |
Alter 70–79 Jahre
|
3/5'750
|
11/5'742
|
nicht abschliessend beurteilbarb
| |
Alter ≥80 Jahre
|
0/995
|
5/981
|
nicht abschliessend beurteilbarb
| |
Mit ≥1 signifikanten Grunderkrankung
|
9/9'387
|
34/9'448
|
73.5 (43.6, 88.8)
| |
RSV-Subgruppe A
|
6/18'050
|
31/18'074
|
80.6 (52.9, 93.4)
| |
RSV-Subgruppe B
|
3/18'050
|
22/18'074
|
86.4 (54.6, 97.4)
|
KI = Konfidenzintervall, RSV = Respiratorisches Synzytial-Virus, IW = Impfstoffwirksamkeit.
a RSV-Saisons 1 und 2 kombiniert, mit einer medianen Nachbeobachtungszeit von 16.4 Monaten.
b Aufgrund der geringen Gesamtzahl der Fälle ist die Impfstoffwirksamkeit nicht abschliessend beurteilbar.
Immunogenität bei Personen mit erhöhtem Risiko für die Entwicklung einer durch RSV verursachten Erkrankung der unteren Atemwege im Alter von 18 bis 59 Jahren
Studien zur klinischen Wirksamkeit von Abrysvo wurden bei Personen im Alter von 60 Jahren und älter durchgeführt (siehe Studie C3671013 oben).
Die Effektivität von Abrysvo bei Personen mit erhöhtem Risiko für die Entwicklung einer durch RSV verursachten Erkrankung der unteren Atemwege im Alter von 18-59 Jahren kann abgeleitet werden aufgrund einer vergleichbaren Immunantwort wie bei einer Untergruppe von Personen in der Studie C3671013, bei der die Wirksamkeit des Impfstoffs nachgewiesen wurde (Immunobridging).
C3671023 Substudie A war eine multizentrische, randomisierte, doppelblinde, placebokontrollierte Phase 3-Studie zur Beurteilung der Sicherheit und Immunogenität von Abrysvo bei Personen im Alter von 18 bis 59 Jahren mit erhöhtem Risiko für die Entwicklung einer durch RSV verursachten Erkrankung der unteren Atemwege. In der Studie wurden Personen mit chronischen Lungenerkrankungen (einschliesslich Asthma), kardiovaskulären Erkrankungen (mit Ausnahme von isolierter Hypertonie), Nieren-, Leber-, neurologischen, hämatologischen oder Stoffwechselerkrankungen (einschliesslich Diabetes mellitus und Hyper-/Hypothyreose) aufgenommen. Immungeschwächte Personen wurden von der Studie ausgeschlossen. Die Teilnehmenden wurden im Verhältnis 2:1 randomisiert und erhielten eine Einzeldosis Abrysvo (n=437) oder Placebo (n=217).
Die demografischen Merkmale in C3671023 Substudie A waren in Bezug auf Alter, ethnische Herkunft und Zugehörigkeit bei den Teilnehmenden, die Abrysvo erhielten, und denen, die Placebo bekamen, im Allgemeinen ähnlich. Dreiundfünfzig Prozent (53%) waren 18 bis 49 Jahre alt, und 47% waren 50 bis 59 Jahre alt. Die Impfstoff- und die Placebogruppe waren in Bezug auf das Vorliegen mindestens einer vordefinierten Erkrankung ähnlich, darunter 53% mit ≥1 chronischen Lungenerkrankung, 8% mit ≥1 kardiovaskulären Erkrankung, 42% mit Diabetes mellitus und 31% mit ≥1 anderen Erkrankung (Leber-, Nieren-, neurologische, hämatologische oder andere Stoffwechselerkrankung).
Die Kriterien der Nichtunterlegenheit wurden bei Personen mit erhöhtem Risiko im Alter von 18 bis 59 Jahren im Vergleich zu Personen ab einem Alter von 60 Jahren für das Verhältnis des geometrischen Mittels der Titer (geometric mean titer, GMT) der RSV-neutralisierenden Antikörper um die unteren Grenzen der zweiseitigen 95%-KI >0.667 (1.5-fache Nichtunterlegenheitsgrenze) und für die Differenz der Seroresponse-Raten um die unteren Grenzen der zweiseitigen 95%-KI >-10% sowohl für RSV A als auch für RSV B erfüllt.
Tabelle 6 Vergleich der modellbereinigten GMT der RSV-neutralisierenden Antikörper 1 Monat nach der Impfung mit Abrysvo bei Teilnehmenden im Alter von 18 bis 59 Jahren mit erhöhtem Risiko (C3671023 Substudie A, SSA) im Vergleich zu Teilnehmenden ab einem Alter von 60 Jahren (Studie C3671013)
|
|
Populationsgruppe und ANCOVA-angepasste GMT
|
| |
|
C3671023 SSA
18-59 Jahre mit erhöhtem Risiko
|
C3671013
≥60 Jahre
|
ANCOVA-Vergleich
| |
RSV-Untergruppen
|
n
|
Angepasster GMT (95%-KI)
|
n
|
Angepasster GMT (95%-KI)
|
Angepasstes GMR (95%-KI)
| |
A
|
435
|
41'097 (37'986, 44'463)
|
408
|
26'225 (24'143, 28'486)
|
1.57 (1.396, 1.759)
| |
B
|
437
|
37'416 (34'278, 40'842)
|
408
|
24'680 (22'504, 27'065)
|
1.52 (1.333, 1.725)
|
ANCOVA = Kovarianzanalyse; KI = Konfidenzintervall; GMR = geometrisches Mittelverhältnis; GMT = geometrisches Mittel der Titer
Tabelle 7 Vergleich der Seroresponse-Raten der GMT der RSV-neutralisierenden Antikörper 1 Monat nach der Impfung mit Abrysvo bei Teilnehmenden im Alter von 18 bis 59 Jahren mit erhöhtem Risiko (C3671023 Substudie A, SSA) im Vergleich zu Teilnehmenden ab einem Alter von 60 Jahren (Studie C3671013)
|
|
Populationsgruppe
|
| |
|
C3671023 SSA
18-59 Jahre mit erhöhtem Risiko
|
C3671013
≥60 Jahre
|
Vergleich
| |
RSV-Untergruppen
|
n/N (%)
|
95%-KI
|
n/N (%)
|
95%-KI
|
Differenz (95%-KI)
| |
A
|
405/435 (93)
|
90.3, 95.3
|
359/408 (88)
|
84.4, 91.0
|
5.1 (1.2, 9.2)
| |
B
|
408/437 (93)
|
90.6, 95.5
|
347/408 (85)
|
81.2, 88.4
|
8.3 (4.2, 12.6)
|
KI = Konfidenzintervall; GMT = geometrisches Mittel der Titer
Immunogenität bei immungeschwächten Personen ab einem Alter von 18 Jahren
C3671023 Substudie B war eine einarmige, offene, multizentrische Phase-3-Studie zur Bewertung der Sicherheit und Immunogenität von Abrysvo bei immungeschwächten Personen im Alter von ≥18 Jahren (N=203). Die Teilnehmenden hatten sich mindestens 3 Monate vor Studienbeginn der Transplantation eines soliden Organs (Niere, Leber, Lunge oder Herz) unterzogen (n (%) = 75 (36.9%)), wiesen eine terminale Nierenerkrankung auf und erhielten eine Hämodialyse (n (%) = 31 (15.3%)), hatten eine entzündliche Autoimmunerkrankung mit aktiver Immunmodulationstherapie (n (%) = 97 (47.8%)) oder litten an fortgeschrittenem nicht-kleinzelligem Lungenkrebs und erhielten eine aktive Immunmodulationstherapie (n (%) = 5 (2.5%)). Die Teilnehmenden erhielten 2 Dosen Abrysvo in einem Abstand von 1 Monat.
Eine Einzeldosis Abrysvo löste bei Teilnehmenden im Alter von ≥18 Jahren unter immunschwächenden Bedingungen (n=188) neutralisierende Reaktionen gegen RSV A und RSV B aus, die etwa dem 8- oder 9-Fachen des Ausgangswerts entsprachen. Diese Reaktionen wurden durch eine zweite Dosis Abrysvo 1 Monat nach der ersten Dosis nicht weiter verstärkt.
PharmakokinetikAbsorption
Nicht zutreffend.
Distribution
Nicht zutreffend.
Metabolismus
Nicht zutreffend.
Elimination
Nicht zutreffend.
Präklinische DatenBasierend auf den konventionellen Studien zur Toxizität bei wiederholter Gabe und zur Reproduktions- und Entwicklungstoxizität lassen die präklinischen Daten keine besonderen Gefahren für den Menschen erkennen.
Sonstige HinweiseInkompatibilitäten
Da keine Kompatibilitätsstudien durchgeführt wurden, darf dieses Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Die ungeöffnete Durchstechflasche bleibt bei Lagerung bei Temperaturen zwischen 8-30 °C 5 Tage lang stabil. Nach Ablauf dieses Zeitraums sollte Abrysvo verwendet oder entsorgt werden. Diese Angabe dient lediglich als Orientierungshilfe für medizinisches Fachpersonal im Falle vorübergehender Temperaturabweichungen.
Haltbarkeit nach Anbruch
Abrysvo sollte nach der Rekonstitution umgehend oder bei Lagerung zwischen 15–30 °C innerhalb von 4 Stunden verabreicht werden. Nicht einfrieren.
Die chemische und physikalische Stabilität während des Gebrauchs wurde 4 Stunden lang bei 15–30 °C nachgewiesen. Aus mikrobiologischer Sicht sollte das Produkt sofort verwendet werden. Bei nicht sofortiger Verwendung liegen die Dauer und die Bedingungen der Aufbewahrung vor der Anwendung in der Verantwortung des Anwenders.
Besondere Lagerungshinweise
Im Kühlschrank (2–8 °C) lagern.
Nicht einfrieren. Entsorgen, wenn die Packung eingefroren war.
Ausser Reichweite von Kindern aufbewahren.
Hinweise für die Handhabung
Abrysvo muss vor der Verabreichung durch Zugabe des gesamten Inhalts der Fertigspritze mit Lösungsmittel in die Durchstechflasche mit Pulver unter Verwendung des Durchstechflaschenadapters rekonstituiert werden.
Der Impfstoff darf nur mit dem mitgelieferten Lösungsmittel rekonstituiert werden.
Vorbereitung der Verabreichung
|
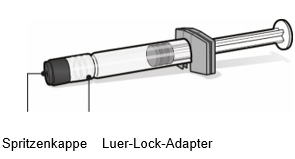
Fertigspritze mit Lösungsmittel für Abrysvo
|
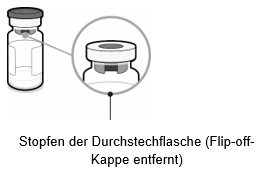
Durchstechflasche mit Antigenen für Abrysvo (Pulver)
|
Durchstechflaschenadapter
| |
|
|
|
|
|
|
|
|
|
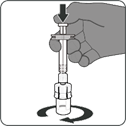
Schritt 1. Durchstechflaschenadapter aufsetzen
·Abdeckfolie von der Packung mit dem Durchstechflaschenadapter abziehen und Flip-off-Kappe von der Durchstechflasche entfernen.
·Durchstechflaschenadapter in der Packung lassen, über die Mitte des Stopfens der Durchstechflasche halten und gerade nach unten auf die Durchstechflasche drücken. Darauf achten, den Durchstechflaschenadapter nicht schräg auf die Durchstechflasche aufzusetzen, da sonst Flüssigkeit austreten kann. Verpackung entfernen.
| |
|
|
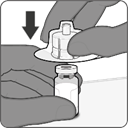
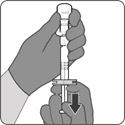
Schritt 2. Pulverkomponente (Antigene) rekonstituieren, um Abrysvo zu erhalten
·Die Spritze während aller Montageschritte der Spritzeneinheit ausschliesslich am Luer-Lock-Adapter festhalten. Dadurch wird verhindert, dass sich der Luer-Lock-Adapter während der Anwendung löst.
·Spritzenkappe durch Drehen entfernen, dann Spritze durch Drehen mit dem Durchstechflaschenadapter verbinden. Nicht weiterdrehen, wenn ein Widerstand zu spüren ist.
·Gesamten Inhalt der Spritze in die Durchstechflasche injizieren. Mit heruntergedrücktem Kolben die Durchstechflasche vorsichtig mit kreisförmigen Bewegungen schwenken, bis sich das Pulver vollständig aufgelöst hat (ca. 1-2 Minuten). Nicht schütteln.
| |
|
|
Schritt 3. Rekonstituierten Impfstoff aufziehen
·Durchstechflasche vollständig auf den Kopf drehen und gesamten Inhalt langsam in die Spritze aufziehen, um eine 0.5 ml Dosis Abrysvo sicherzustellen.
·Spritze vom Durchstechflaschenadapter abschrauben.
·Eine für die intramuskuläre Injektion geeignete sterile Nadel aufsetzen.
|
Der zubereitete Impfstoff ist eine klare und farblose Lösung. Unterziehen Sie den Impfstoff vor der Anwendung einer Sichtprüfung auf grosse Partikel und Verfärbungen. Nicht verwenden, wenn grosse Partikel oder Verfärbungen festgestellt werden.
Zulassungsnummer69691 (Swissmedic).
PackungenPackung mit 1 Durchstechflasche mit Pulver, 1 Fertigspritze mit Lösungsmittel, 1 Durchstechflaschenadapter und 1 Injektionsnadel. [B]
Packung mit 5 Durchstechflaschen mit Pulver, 5 Fertigspritzen mit Lösungsmittel, 5 Durchstechflaschenadapter und 5 Injektionsnadeln. [B]
Packung mit 10 Durchstechflaschen mit Pulver, 10 Fertigspritzen mit Lösungsmittel, 10 Durchstechflaschenadapter und 10 Injektionsnadeln. [B]
ZulassungsinhaberinPfizer AG, Zürich.
Stand der InformationJuli 2025.
LLD V011
|






