Zusammensetzung
Wirkstoffe
C1-Esterase-Inhibitor aus Humanplasma.
Hilfsstoffe
Glycin, Natriumchlorid, Natriumcitrat (entspricht ≤2,1 mmol oder ≤49 mg Natrium).
Lösungsmittel: Aqua ad iniect.: 10 ml.
Indikationen/Anwendungsmöglichkeiten
Erbliches Angioödem
·Therapie des akuten Schubes
·Prophylaxe vor Operationen
Dosierung/Anwendung
Übliche Dosierung
Die Therapie soll von einem in der Behandlung von C1-Esterase-Inhibitor-Mangel erfahrenen Arzt eingeleitet und überwacht werden.
Einzeldosis
20 Internationale Einheiten/kg Körpergewicht.
Um die Rückverfolgbarkeit von Arzneimitteln biologischen Ursprungs sicherzustellen, wird empfohlen Handelsname und Chargennummer bei jeder Behandlung zu dokumentieren.
Kinder und Jugendliche
Kinder und Jugendliche erhalten die gleiche Dosis wie Erwachsene. Die Injektion kann in Abhängigkeit vom klinischen Bild wiederholt werden.
Art der Anwendung
Die Lösung wird langsam i.v. injiziert, z.B. per Infusomat mit 4 ml/min oder über einen Zeitraum von 5 - 10 min.
Kontraindikationen
Überempfindlichkeit gegenüber dem Wirkstoff oder einem der Hilfsstoffe gemäss Zusammensetzung.
Capillary Leak Syndrome (CLS).
Warnhinweise und Vorsichtsmassnahmen
Vorsichtsmassnahmen
Bei Patienten mit bekannten allergischen Reaktionen auf das Präparat sollten Antihistaminika und Kortikosteroide prophylaktisch verabreicht werden. Bei Auftreten von allergisch-anaphylaktischen Reaktionen ist Berinert IV sofort abzusetzen (z.B. durch Unterbrechung der Injektion) und eine situationsgerechte Behandlung einzuleiten.
Therapeutische Massnahmen richten sich nach Art und Schweregrad der Nebenwirkung. Die aktuellen medizinischen Richtlinien zur Schockbehandlung sind zu beachten.
Patienten mit Larynxödem bedürfen besonders sorgfältiger Überwachung in Notfallbereitschaft.
Bei Therapieversuchen mit hochdosierten Gaben von Berinert IV zur Vorbeugung oder Behandlung eines Capillary Leak Syndromes (CLS) vor, während und nach Herzoperationen unter Einsatz der Herz-Lungen-Maschine (nicht zugelassene Indikation und Dosierung) wurde über Bildung von Thrombosen mit zum Teil tödlichem Ausgang berichtet. Diese Anwendung ist daher kontraindiziert. Für weitere Informationen zum Thromboserisiko (d.h. Häufigkeit) siehe «Unerwünschte Wirkungen».
Berinert IV enthält ≤2,1 mmol (49 mg) Natrium pro Flasche, das entspricht 2,5 % der von der WHO empfohlenen maximalen täglichen Zufuhr von 2 g Natrium für einen Erwachsenen.
Häusliche Behandlung und Selbstverabreichung
Zur Anwendung dieses Arzneimittels im Rahmen der häuslichen Behandlung oder der Selbstverabreichung liegen begrenzte Daten vor. Bei einer häuslichen Behandlung sind insbesondere die Risiken einer Überempfindlichkeitsreaktion zu beachten. Die Entscheidung hinsichtlich einer häuslichen Behandlung ist in jedem Einzelfall vom behandelnden Arzt zu treffen. Der Arzt sollte sicherstellen, dass eine entsprechende Unterweisung erfolgt und die richtige Anwendung regelmässig überprüft wird.
Virale Sicherheit
Berinert IV wird aus humanem Plasma hergestellt. Standardmassnahmen zur Verhinderung von Infektionen durch den Einsatz von aus Blut oder Blutplasma hergestellten Arzneimitteln schliessen die Auswahl der Spender und das Screening der einzelnen Spenden und Plasmapools auf spezifische Infektionsmarker sowie effektive Schritte zur Inaktivierung/Eliminierung von Viren im Herstellverfahren ein. Dennoch kann bei Arzneimitteln aus menschlichem Blut oder Blutplasma die Möglichkeit der Übertragung von Krankheitserregern nicht vollständig ausgeschlossen werden. Dasselbe gilt auch für bislang unbekannte Viren oder neu aufgetretene Viren und andere Pathogene. Die getroffenen Massnahmen werden als wirksam angesehen für umhüllte Viren, wie z.B. humaner Immunschwächevirus (HIV), Hepatitis-B-Virus (HBV) und Hepatitis-C-Virus (HCV) und für bestimmte nicht umhüllte Viren wie Hepatitis A-Virus (HAV) und Parvovirus B19.
Für Patienten, die C1-Esterase-Inhibitor-Präparate aus Plasma erhalten, wird ein angemessener Hepatitis-Impfschutz (Hepatitis A und B) empfohlen.
Interaktionen
Es wurden keine Interaktionsstudien durchgeführt.
Schwangerschaft, Stillzeit
Schwangerschaft
Berinert IV ist ein physiologischer Bestandteil des menschlichen Blutplasmas. Es liegt eine begrenzte Anzahl von Daten vor, aus welchen kein erhöhtes Risiko bezüglich Fruchtbarkeit, Geburt oder nachgeburtliche Entwicklung beim Menschen bei der Behandlung von schwangeren Frauen mit Berinert IV zu entnehmen ist. Berinert IV sollte in der Schwangerschaft nur nach eindeutiger Indikationsstellung angewendet werden.
Stillzeit
Es ist nicht bekannt, ob Berinert IV in der Muttermilch ausgeschieden wird, aber aufgrund des hohen Molekulargewichts erscheint eine Übertragung von Berinert IV in die Muttermilch als unwahrscheinlich. Die Gabe von Berinert IV während der Stillzeit soll nach Nutzen-Risiko-Abwägung erfolgen.
Fertilität
C1-Esterase-Inhibitor ist ein physiologischer Bestandteil von menschlichem Plasma. Es wurden keine tierexperimentellen Studien zur Fertilität mit Berinert IV durchgeführt.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Es wurden keine Studien zu den Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen durchgeführt
Unerwünschte Wirkungen
Liste der unerwünschten Wirkungen
Die im Folgenden genannten unerwünschten Arzneimittelwirkungen (UAW) beruhen auf Analysen von post-marketing Daten sowie der wissenschaftlichen Literatur. Die unerwünschten Wirkungen sind nach MedDRA-Systemorganklassen und Häufigkeit gemäss folgender Konvention geordnet:
Sehr häufig: ≥1/10;
häufig: ≥1/100 bis < 1/10;
gelegentlich: ≥1/1000 bis < 1/100;
selten: ≥1/10'000 bis < 1/1000;
sehr selten: < 1/10'000
nicht bekannt (kann aus den verfügbaren Daten nicht abgeschätzt werden)
Erkrankungen des Immunsystems:
Selten: Allergisch-anaphylaktische Reaktionen (wie z.B. Tachykardie, Hyper- oder Hypotension, Flush, Urtikaria, Dyspnoe, Kopfschmerzen, Schwindel, Übelkeit)
Sehr selten: Schock
Gefässerkrankungen:
Selten: Bildung von Thrombosen (siehe «Warnhinweise und Vorsichtsmassnahmen»)
Allgmeine Erkrankungen und Beschwerden am Verabreichungsort:
Selten: Temperaturanstieg und/oder Reaktionen an der Einstichstelle
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Es wurden keine Fälle einer Überdosierung berichtet.
Eigenschaften/Wirkungen
ATC-Code
B06AC01
Berinert IV wird aus gepooltem, humanem Plasma gesunder Spender gewonnen. Informationen über die Testung von Spenden und Plasmapools sind unter Kapitel «Warnhinweise und Vorsichtsmassnahmen» beschrieben. Der Herstellungsprozess von Berinert IV beinhaltet verschiedene Schritte, die zur Eliminierung/Inaktivierung von Viren beitragen. Die Hitzebehandlung des Präparates in wässriger Lösung bei 60 °C über 10 Stunden wurde zur Virusinaktivierung eingeführt.
Für Informationen zum Infektionsrisiko s. auch «Warnhinweise und Vorsichtsmassnahmen».
Wirkungsmechanismus
C1-Esterase-Inhibitor ist ein Plasmaglycoprotein mit einem Molekulargewicht von 105 kD und einem Kohlenhydrat-Anteil von 40 %. Seine Konzentration im menschlichen Plasma beträgt ca. 240 mg/l. Ausser dem menschlichen Plasma, enthalten auch Placenta, Leberzellen, Monozyten und Thrombozyten C1-Esterase-Inhibitor. Der therapeutische Effekt von Berinert IV bei erblichem Angioödem entsteht durch die Substitution der fehlenden C1-Esterase-Inhibitor-Aktivität.
Pharmakodynamik
C1-Esterase-Inhibitor gehört zu dem Serin-Protease-Inhibitor-(Serpin)-System des menschlichen Plasmas wie z.B. auch Antithrombin III, Alpha-2-Antiplasmin, Alpha-1-Antitrypsin und andere Proteine.
Unter physiologischen Bedingungen hemmt C1-Esterase-Inhibitor den klassischen Weg der Aktivierung der Komplementkaskade durch Inaktivierung der enzymatisch aktiven Komponente C1s und C1r. Die aktiven Enzyme bilden einen Komplex mit dem Inhibitor in einem Verhältnis von 1:1. Ausserdem ist C1-Esterase-Inhibitor der wichtigste Inhibitor der Kontaktaktivierung, indem er Faktor XIIa und seine Fragmente hemmt und neben Alpha-2-Macroglobulin der wichtigste Inhibitor des plasmatischen Kallikrein ist.
Klinische Wirksamkeit
Die klinische Wirksamkeit von Berinert IV wurde in zwei Studien untersucht.
Die Sicherheit und Wirksamkeit von Berinert IV zur Behandlung akuter abdominaler und fazialer HAE-Schübe wurde im Rahmen einer placebokontrollierten, doppelblinden, prospektiven, multinationalen, randomisierten, dreiarmigen klinischen Parallelgruppen-Studie zur Dosisfindung mit erwachsenen und pädiatrischen Patienten mit C1-Esterase-Inhibitor-Mangel gezeigt (Studie CE1145_3001). Sie wird im Folgenden als randomisierte klinische Studie (RCT-Studie) bezeichnet. Die Patienten waren zwischen 6 und 72 Jahren alt und erhielten nach dem Zufallsprinzip entweder eine Einzeldosis mit 10 I.E./kg Körpergewicht Berinert IV (39 Patienten), eine Einzeldosis mit 20 I.E./kg Körpergewicht Berinert IV (43 Patienten) oder eine Einzeldosis Placebo (42 Patienten) mittels langsamer intravenöser Infusion innerhalb von 5 Stunden nach einem HAE-Schub. Patienten, die 20 I.E./kg Körpergewicht Berinert IV erhielten, zeigten eine statistisch signifikante Reduktion der vom Patienten beurteilten Zeit bis zum Einsetzen der Symptomlinderung nach einem HAE-Schub im Vergleich zu Placebo (im Median von 1,5 auf 0,5 Stunden). Die Dosis von 10 I.E./kg Körpergewicht Berinert IV wurde aufgrund einer fehlenden signifikanten Wirksamkeit gegenüber Placebo nicht weiter untersucht.
Die in einer prospektiven, offenen, unkontrollierten, multizentrischen Verlängerungsstudie (Studie CE1145_3003) der RCT-Studie beobachteten Behandlungseffekte waren konsistent mit den Resultaten der RCT-Studie.
Pharmakokinetik
Die pharmakokinetischen Eigenschaften wurden in 40 Patienten mit hereditärem Angioödem untersucht (6 Patienten jünger als 18 Jahre). Unter ihnen waren 15 Patienten mit häufigen/schweren Schüben, welche eine prophylaktische Behandlung erhielten, sowie 25 Patienten mit weniger häufigen/milden Schüben und Behandlung bei Bedarf. Die Daten wurden in einem beschwerdefreien Intervall oder bei milden Beschwerden erhoben.
Absorption
Das Präparat wird intravenös appliziert und ist sofort in der Dosierung entsprechenden Plasmakonzentration verfügbar.
Distribution
Die mediane in-vivo Recovery (IVR) betrug 86,7 % (Bereich: 54,0 – 254,1 %). Sie war bei Kindern mit 98,2 % (Bereich: 69,2 – 106,8 %) etwas höher als bei Erwachsenen (82,5 %, Bereich: 54,0 – 254,1 %). Patienten mit schweren Attacken hatten eine höhere IVR (101,4 %) als Patienten mit leichten Attacken (75,8 %, Bereich: 57,2 – 195,9 %).
Der mittlere Aktivitätsanstieg (Median) betrug 2,3 %/ I.E./kg Körpergewicht (KG) (Bereich: 1,4 – 6,9 %/ I.E./kg KG). Es wurden keine signifikanten Unterschiede zwischen Erwachsenen und Kindern festgestellt. Patienten mit schweren Schüben zeigten einen leicht höheren Anstieg der Aktivität als Patienten mit milden Schüben (2,9; Bereich: 1,4 – 6,9 vs. 2,1: Bereich: 1,5 - 5,1 %/ I.E./kg KG).
Die maximale Plasma-Konzentration der C1-Esterase-Aktivität wurde innerhalb von 0,8 Stunden nach Verabreichung von Berinert IV erreicht, ohne signifikante Unterschiede zwischen den Patientengruppen.
Metabolismus
Keine Daten vorhanden.
Elimination
Die mittlere Halbwertszeit (Median) betrug 36,1 h. Sie war geringfügig kürzer bei Kindern als bei Erwachsenen (32,9 gegenüber 36,1 h) und bei Patienten mit schweren Schüben als bei Patienten mit milden Schüben (30,9 gegenüber 37,0 h).
Präklinische Daten
Der in Berinert IV enthaltene arzneilich wirksame Bestandteil C1-Esterase-Inhibitor wurde aus humanem Plasma gewonnen und verhält sich wie körpereigene Plasmabestandteile. Die einmalige Verabreichung von Berinert IV an Ratten und Mäusen, sowie die wiederholte Gabe an Ratten ergaben keine Hinweise auf toxische Nebenwirkungen.
In-vivo-Thrombogenitätstest bei Kaninchen zeigten kein Thromboserisiko nach der intravenösen Anwendung von C1-Esterase-Inhibitor.Es wurden keine Studien zur Karzinogenität und Reproduktionstoxizität durchgeführt.
Sonstige Hinweise
Inkompatibilitäten
Da keine Kompatibilitätsstudien durchgeführt wurden, darf das Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
Haltbarkeit
Berinert IV darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Haltbarkeit nach Rekonstitution
Nach Rekonstitution ist die physiko-chemische Stabilität für 48 Stunden bei Raumtemperatur (max. 30 °C) belegt. Aus mikrobiologischen Gründen und da Berinert IV kein Konservierungsmittel enthält, sollte die gebrauchsfertige Zubereitung sofort nach der Rekonstitution verwendet werden. Wenn das gelöste Produkt nicht sofort angewendet werden kann, sollte es nicht länger als 8 Stunden bei Raumtemperatur aufbewahrt werden. Das gelöste Produkt darf nur in der Flasche aufbewahrt werden.
Besondere Lagerungshinweise
Nicht über 30 °C lagern. Nicht einfrieren. Die Flasche in der geschlossenen Faltschachtel aufbewahren, um den Inhalt vor Licht zu schützen! Haltbarkeit der verwendungsfertigen Zubereitung: siehe „Haltbarkeit nach Rekonstitution“. Arzneimittel für Kinder unzugänglich aufbewahren!
Nicht verwendetes Arzneimittel oder Abfallmaterial sind entsprechend den lokalen Anforderungen zu entsorgen.
Hinweise für die Handhabung
Herstellung der Lösung:
Allgemeine Hinweise:
·Die Lösung sollte farblos und klar sein. Rekonstituiertes Produkt sollte nach der Filtration/dem Aufziehen der Lösung in die Spritze (siehe unten) und vor der Anwendung auf Partikel und Verfärbungen visuell überprüft werden.
·Trübe Lösungen oder Lösungen mit Rückständen (Niederschlägen/Partikeln) dürfen nicht verwendet werden.
·Zubereitung und Entnahme müssen unter aseptischen Bedingungen erfolgen. Verwenden Sie hierfür nur die der Packung beigefügte Spritze.
Zubereitung:
Erwärmen Sie das Lösungsmittel auf Raumtemperatur. Vor dem Öffnen der Transferset-Packung («Mix2Vial™») die Flip-Off-Kappen der Lösungsmittel- und Produktflaschen entfernen und die Stopfen mit einer antiseptischen Lösung behandeln und anschliessend trocknen lassen.
|
|
|
1. Entfernen Sie das Deckpapier von der «Mix2Vial» Packung. Das Mix2Vial nicht aus dem Blister entnehmen! |
|
|
|
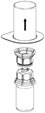
2. Die Lösungsmittelflasche auf eine ebene, saubere Fläche stellen und festhalten. Das «Mix2Vial» Set mit dem Blister greifen und die blaue Seite des Adapters voran senkrecht in den Stopfen der Lösungsmittelflasche einstechen. |
|
|
|
3. Vorsichtig die Verpackung vom «Mix2Vial» Set entfernen, indem man den Blister am Siegelrand fasst und ihn senkrecht nach oben abzieht. Dabei ist darauf zu achten, dass nur der Blister und nicht das «Mix2Vial» entfernt wird. |
|
|
|
4. Die Produktflasche auf eine feste Unterlage stellen. Die Lösungsmittelflasche mit dem aufgesetzten «Mix2Vial» Set herumdrehen und analog den Dorn der transparenten Seite senkrecht in den Stopfen der Produktflasche einstechen. Das Lösungsmittel läuft automatisch in die Produktflasche über. |
|
|
|
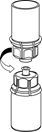
5. Mit der einen Hand die Produktseite und mit der anderen Hand die Lösungsmittelseite des «Mix2Vial» greifen und das Set vorsichtig auseinanderschrauben. Entsorgen Sie die Lösungsmittelflasche mit dem blauen «Mix2Vial» Adapter. |
|
|
|
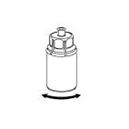
6. Die Produktflasche mit dem transparenten Adapter vorsichtig schwenken, bis das Produkt vollständig gelöst ist. Nicht schütteln. |
|
|
|
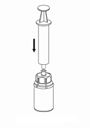
7. Luft in eine leere, sterile Spritze aufziehen. Hierfür nur die der Packung beigefügte Spritze verwenden. Die Produktflasche aufrecht halten, die Spritze mit dem Luer Lock Anschluss des «Mix2Vial» Set verbinden und die Luft in die Produktflasche injizieren. |
Aufziehen der Lösung in die Spritze
|
|
|
8. Den Stempel der Spritze gedrückt halten, das gesamte System herumdrehen und die Lösung durch langsames Zurückziehen der Kolbenstange in die Spritze aufziehen. |
|
|
|
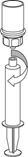
9. Nachdem die Lösung vollständig in die Spritze überführt ist, den Spritzenzylinder fassen (dabei die Kolbenstange in ihrer Position halten) und die Spritze vom transparenten «Mix2Vial»-Adapter abdrehen. |
Zulassungsnummer
51950 (Swissmedic)
Packungen
Berinert IV (B)
1 Flasche mit Trockensubstanz (500 I.E.)
1 Flasche mit 10 ml Wasser für Injektionszwecke
1 Filter Transfer Set 20/20
1 Verabreichungsset (beigepackter Zusatzkarton):
1 Venenpunktionsbesteck
2 Alkoholtupfer
1 nicht steriles Pflaster
1 Einmalspritze
Zulassungsinhaberin
CSL Behring AG, Bern
Stand der Information
März 2022