Zusammensetzung
Wirkstoffe
Miglustat.
Hilfsstoffe
Kapselinhalt: Vorverkleisterte Stärke (Mais), Magnesiumstearat (E470b), mikrokristalline Cellulose (E460i), Sucralose (E955), hochdisperses Siliciumdioxid.
Kapselhülle: Gelatine, Titandioxid (E171), schwarzes Eisenoxid (E172)
Drucktinte: schwarzes Eisenoxid (E172), Kaliumhydroxid (E525), Propylenglycol (E1520), Schellack (E904), konzentrierte Ammoniak-Lösung (E527).
Indikationen/Anwendungsmöglichkeiten
Opfolda (Miglustat) ist ein Enzymstabilisator von Cipaglucosidase alfa zur langfristigen Enzymersatztherapie bei Erwachsenen mit Morbus Pompe (Mangel an saurer α-Glucosidase [GAA]) der späten Verlaufsform (late-onset Pompe disease, LOPD).
Dosierung/Anwendung
Die Behandlung sollte von einem Arzt überwacht werden, der Erfahrung in der Behandlung von Patienten mit Morbus Pompe oder anderen erblichen metabolischen oder neuromuskulären Erkrankungen hat.
Miglustat 65 mg Hartkapseln müssen in Kombination mit Cipaglucosidase alfa angewendet werden. Vor der Einnahme von Miglustat ist die Fachinformation für Cipaglucosidase alfa zu beachten.
Übliche Dosierung
Die empfohlene Dosis wird von Erwachsenen ab 18 Jahren alle zwei Wochen eingenommen und richtet sich nach dem Körpergewicht:
·Für Patienten mit einem Körpergewicht ≥50 kg beträgt die empfohlene Dosis 260 mg (4 Kapseln zu 65 mg).
·Für Patienten mit einem Körpergewicht ≥40 kg bis <50 kg beträgt die empfohlene Dosis 195 mg (3 Kapseln zu 65 mg).
Miglustat 65 mg Hartkapseln sind etwa 1 Stunde, aber höchstens 3 Stunden vor Beginn der Cipaglucosidase-alfa-Infusion einzunehmen.
Abbildung 1. Verabreichungszeitplan
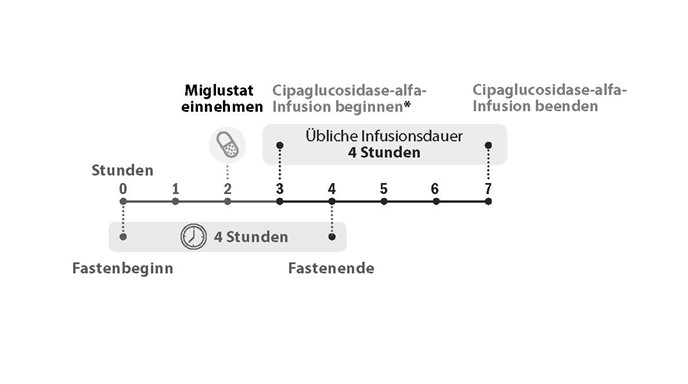
* Miglustat 65 mg Hartkapseln sind etwa 1 Stunde, aber höchstens 3 Stunden vor Beginn der Cipaglucosidase-alfa-Infusion einzunehmen.
Das Ansprechen des Patienten auf die Behandlung ist regelmässig basierend auf einer umfassenden Beurteilung aller klinischen Manifestationen der Erkrankung zu untersuchen. Bei unzureichendem Ansprechen oder nicht tolerierbaren Sicherheitsrisiken ist ein Abbruch der Behandlung mit Miglustat 65 mg Hartkapseln in Kombination mit Cipaglucosidase alfa zu erwägen. Es sind beide Arzneimittel entweder weiter zu verabreichen oder abzusetzen.
Versäumte Dosis
Wenn die Einnahme von Miglustat versäumt wird, hat die Einnahme so bald wie möglich zu erfolgen. Ohne Einnahme von Miglustat darf die Cipaglucosidase-alfa-Infusion nicht begonnen werden. Die Cipaglucosidase-alfa-Infusion kann 1 Stunde nach der Einnahme von Miglustat beginnen.
Besondere Dosierungsanweisungen
Patienten mit Leber- und Nierenfunktionsstörungen
Die Sicherheit und Wirksamkeit der Behandlung mit Miglustat in Kombination mit Cipaglucosidase alfa wurden bei Patienten mit eingeschränkter Nieren- und/oder Leberfunktion nicht untersucht. Bei einer Verabreichung alle zwei Wochen ist nicht zu erwarten, dass eine erhöhte Plasma-Miglustat-Exposition infolge einer mittelschweren oder schweren Nieren- oder Leberfunktionsstörung die Cipaglucosidase-alfa-Exposition nennenswert beeinflusst, oder die Sicherheit und Wirksamkeit von Cipaglucosidase alfa in klinisch bedeutsamer Weise beeinträchtigt. Bei Patienten mit einer Nieren- oder Leberfunktionsstörung ist keine Dosisanpassung erforderlich.
Ältere Patienten
Es gibt nur begrenzte Erfahrungen mit der Anwendung von Miglustat in Kombination mit Cipaglucosidase alfa bei Patienten über 65 Jahren. Bei älteren Patienten ist keine Dosisanpassung erforderlich.
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit der Behandlung mit Miglustat in Kombination mit Cipaglucosidase alfa bei pädiatrischen Patienten unter 18 Jahren sind bisher noch nicht erwiesen. Es liegen keine Daten vor.
Art der Anwendung
Miglustat ist zum Einnehmen bestimmt.
Die Miglustat Hartkapsel weist eine Krempe auf, um das Öffnen der Kapselhülle zu verhindern, und sie muss im Ganzen geschluckt und auf nüchternen Magen eingenommen werden.
Die Patienten dürfen 2 Stunden vor und 2 Stunden nach der Einnahme von Miglustat 65 mg Hartkapseln keine Nahrung zu sich nehmen (siehe Abschnitt „Pharmakokinetik“). Während dieser 4stündigen Fastenperiode können Wasser, fettfreie (entrahmte) Kuhmilch und Tee oder Kaffee ohne Rahm, Zucker oder Süssstoffe getrunken werden. 2 Stunden nach der Einnahme von Miglustat kann der Patient wieder normal essen und trinken.
Kontraindikationen
·Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt «Zusammensetzung» genannten Hilfsstoffe.
·Kontraindikation für Cipaglucosidase alfa.
Warnhinweise und Vorsichtsmassnahmen
Bei der Anwendung von Miglustat in Kombination mit Cipaglucosidase alfa können unerwünschte Arzneimittelwirkungen auftreten (siehe Abschnitt «Unerwünschte Wirkungen»).
Interaktionen
Es wurden keine klinischen Studien zur Erfassung von Wechselwirkungen im Zusammenhang mit der Anwendung von Miglustat durchgeführt.
Basierend auf In-vitro-Daten ist Miglustat kein Substrat von OAT1, OAT3, OATP1B1, OATP1B3, MATE1, MATE2-K, BCRP oder BSEP. Miglustat ist ein schwaches Substrat von P-Glykoprotein (P-gp) und ein Substrat der Aufnahmetransporter OCT1 (in der Leber exprimiert) und OCT2 (in der Niere exprimiert). Da Miglustat grösstenteils unmetabolisiert über die Nieren ausgeschieden wird, ist nicht davon auszugehen, dass OCT1-Inhibitoren zu einer klinisch bedeutsamen Wechselwirkung führen. Basierend auf Daten von Patienten mit schwerer Nierenfunktionsstörung ist nicht davon auszugehen, dass OCT2-Inhibitoren einen klinisch bedeutsamen Einfluss auf die renale Ausscheidung und Exposition von Miglustat haben. Basierend auf Fastenempfehlungen und der schnellen Absorption von Miglustat (tmax von 2 Stunden) ist nicht davon auszugehen, dass P-Glykoprotein (P-gp)-Inhibitoren zu einer klinisch bedeutsamen Wechselwirkung mit Miglustat im Darm führen.
Miglustat ist kein bekanntes Substrat oder bekannter Inhibitor von Cytochrom P450-Enzymen; daher sind signifikante Wechselwirkungen mit Arzneimitteln, die Substrate von Cytochrom P450-Enzymen sind, unwahrscheinlich.
Basierend auf einer In-vitro-Transporterstudie ist Miglustat kein Inhibitor der Transporter OAT1, OAT3, OCT1, OCT2, OATP1B1, OATP1B3 oder BSEP. Klinisch bedeutsame Wechselwirkungen im Darm mit P-gp- und BCRP-Substraten und in der Leber an der Pfortader mit OCT1, OATP1B1 und OATP1B3 sind aufgrund der Fastenempfehlungen und der schnellen Absorption von Miglustat nicht zu erwarten.
Wechselwirkung mit Nahrung
Es ist bekannt, dass Miglustat eine direkte Wirkung auf die enzymatische Funktion wichtiger Disaccharidasen des Darmepithels hat. Insbesondere hemmt Miglustat Disaccharidasen mit alphaglykosidischen Bindungen wie Sucrase, Maltase und Isomaltase. Das Ausmass der potenziellen Wechselwirkungen kann die Verdauung von Saccharose, Maltose und Isomaltose unmittelbar beeinträchtigen, was zu Maldigestion, osmotischem Wassereinstrom, verstärkter Fermentation und der Bildung reizender Metaboliten führt. Die Patienten dürfen 2 Stunden vor und 2 Stunden nach der Einnahme von Miglustat keine Nahrung zu sich nehmen.
Schwangerschaft, Stillzeit
Empfängnisverhütung bei Frauen
Frauen im gebärfähigen Alter müssen während der Behandlung mit Miglustat in Kombination mit Cipaglucosidase alfa und für 4 Wochen nach Beendigung der Behandlung zuverlässige Verhütungsmethoden anwenden (siehe «Präklinische Daten»). Miglustat in Kombination mit Cipaglucosidase alfa wird bei Frauen im gebärfähigen Alter, die nicht zuverlässig verhüten, nicht empfohlen.
Schwangerschaft
Es liegen keine klinischen Daten aus der Anwendung von Miglustat in Kombination mit Cipaglucosidase alfa bei Schwangeren vor.
Tierexperimentelle Studien mit Miglustat allein sowie mit Cipaglucosidase alfa in Kombination mit Miglustat haben Reproduktionstoxizität gezeigt (siehe «Präklinische Daten»).
Das potenzielle Risiko für den Menschen ist nicht bekannt. Miglustat passiert die Plazentaschranke.
Miglustat allein oder Cipaglucosidase alfa in Kombination mit Miglustat soll nicht während der Schwangerschaft eingenommen werden.
Stillzeit
Es ist nicht bekannt, ob Miglustat und Cipaglucosidase alfa in die Muttermilch ausgeschieden werden (siehe «Präklinische Daten»). Tierexperimentelle Daten weisen auf die Sekretion von Miglustat und die Ausscheidung von Cipaglucosidase alfa in die Milch hin. Ein Risiko für Neugeborene/Kinder kann nicht ausgeschlossen werden. Es muss eine Entscheidung darüber getroffen werden, ob das Stillen abzubrechen ist oder ob auf die Behandlung mit Miglustat in Kombination mit Cipaglucosidase alfa verzichtet werden soll bzw. die Behandlung abzubrechen ist. Dabei ist sowohl der Nutzen des Stillens für das Kind als auch der Nutzen der Therapie für die Frau zu berücksichtigen.
Fertilität
Es liegen keine klinischen Daten bezüglich der Auswirkungen von Miglustat in Kombination mit Cipaglucosidase alfa auf die Fertilität vor.
Präklinische Daten haben gezeigt, dass Miglustat Spermienparameter negativ beeinflusst (Motilität und Morphologie) und so die Fertilität reduziert (siehe «Präklinische Daten»). Bei 7 gesunden erwachsenen Männern, die 6 Wochen lang zweimal täglich 100 mg Miglustat einnahmen, wurden jedoch keine Auswirkungen auf die Konzentration, Motilität oder Morphologie der Spermien festgestellt.
In weiblichen Ratten wurde ein erhöhter Präimplantationsverlust sowohl bei Miglustat in Kombination mit Cipaglucosidase alfa als auch bei Miglustat allein beobachtet (siehe «Präklinische Daten»).
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Miglustat hat keinen oder einen zu vernachlässigenden Einfluss auf die Fahrtüchtigkeit oder die Fähigkeit, Maschinen zu bedienen.
Unerwünschte Wirkungen
Zusammenfassung des Sicherheitsprofils
Die am häufigsten berichteten Nebenwirkungen, die der Kombination von Cipaglucosidase alfa und Miglustat zuzuschreiben waren, waren Kopfschmerzen (8,6%), Ermüdung (4,6%), Abdominalschmerz (4,0%), Übelkeit (4,0%), Diarrhö (3,3%), Muskelkrämpfe (3,3%), Erbrechen (2,6%), Bauch aufgetrieben (2,0%), Myalgie (2,0%), Fieber (2,0%), Tachykardie (2,0%), Hyperhidrosis (2,0%), Arthralgie (1,3%), Schüttelfrost (1,3%), Dysgeusie (1,3%), Dyspnoe (1,3%), Flatulenz (1,3%), Hypotonie (1,3%), muskuläre Schwäche (1,3%), Pruritus (1,3%), Ausschlag (1,3%), Tremor (1,3%) und Urtikaria (1,3%).
Die am häufigsten gemeldeten Nebenwirkungen, die nur auf Cipaglucosidase alfa zurückzuführen waren, waren Kopfschmerzen (7,3%), Fieber (4,6%), Schüttelfrost (4,0%), Ermüdung (4,0%), Übelkeit (4,0%), Urtikaria (4,0%), Dyspnoe (3,3%), Pruritus (3,3%), Ausschlag (3,3%), Schwindelgefühl (2,6%), Hautrötung mit Hitzegefühl (2,0%), Somnolenz (2,0%), Abdominalschmerz (1,3%), Blutdruck erhöht (1,3%), Brustkorbbeschwerden (1,3%), Husten (1,3%), Myalgie (1,3%), Schmerzen (1,3%) und Schwellung an der Infusionsstelle (1,3%).
Die am häufigsten berichteten nur Miglustat 65 mg zuzuschreibenden Nebenwirkungen waren Diarrhö (5,3%), Übelkeit (3,3%), Abdominalschmerz (2,0%), Bauch aufgetrieben (1,3%), Obstipation (1,3%), Flatulenz (1,3%), Muskelkrämpfe (1,3%) und Tremor (1,3%).
Gemeldete schwerwiegende Nebenwirkungen, die auf die Kombination von Cipaglucosidase alfa und Miglustat zurückzuführen waren, waren Anaphylaxie (0,7%), Hypotonie (0,7%) und Urtikaria (0,7%).
Gemeldete schwerwiegende Nebenwirkungen, die nur auf Cipaglucosidase alfa zurückzuführen waren, waren Urtikaria (1,3%), Anaphylaxie (0,7%), Schüttelfrost (0,7%), Husten (0,7%), Dyspnoe (0,7%), Hautrötung mit Hitzegefühl (0,7%), pharyngeales Ödem (0,7%), Präsynkope (0,7%), Fieber (0,7%) und Giemen (0,7%).
Keine schwerwiegenden Nebenwirkungen waren auf Miglustat allein zurückzuführen.
Liste der unerwünschten Wirkungen
Die Bewertung der Nebenwirkungen basiert auf Teilnehmern der gepoolten Sicherheitsanalyse in den 3 klinischen Studien, die Miglustat in Kombination mit Cipaglucosidase alfa erhielten. Die gesamte mittlere Expositionsdauer betrug 28,0 Monate.
Nebenwirkungen sind in Tabelle 1 nach Systemorganklasse gemäss MedDRA aufgelistet. Die entsprechenden Häufigkeitskategorien sind wie folgt definiert: sehr häufig (≥1/10), häufig (≥1/100, <1/10) und gelegentlich (≥1/1.000, <1/100).
Tabelle 1: Zusammenfassung der Nebenwirkungen aus klinischen Studien mit Miglustat/Cipaglucosidase alfa-behandelten Patienten
|
Systemorganklasse (SOC) |
Häufigkeit |
Nebenwirkung (bevorzugte Bezeichnung) |
|
Erkrankungen des Immunsystems |
Häufig |
Anaphylaktische Reaktion1 |
|
Gelegentlich |
Überempfindlichkeit | |
|
Erkrankungen des Nervensystems |
Sehr häufig |
Kopfschmerzen (13,9%) |
|
Häufig |
Schwindelgefühl*, Tremor, Somnolenz*, Dysgeusie, Parästhesie | |
|
Gelegentlich |
Gleichgewichtsstörung, Brennen*, Migräne4, Präsynkope* | |
|
Herzerkrankungen |
Häufig |
Tachykardie5 |
|
Gefässerkrankungen |
Häufig |
Hautrötung mit Hitzegefühl*, Hypertonie, Hypotonie |
|
Gelegentlich |
Blässe | |
|
Erkrankungen der Atemwege, des Brustraums und Mediastinums |
Häufig |
Dyspnoe, Husten* |
|
Gelegentlich |
Asthma, oropharyngeale Beschwerden*, pharyngeales Ödem*, Giemen* | |
|
Erkrankungen des Gastrointestinaltrakts |
Häufig |
Diarrhö, Übelkeit, Abdominalschmerz6, Flatulenz, Bauch aufgetrieben, Erbrechen, Obstipation† |
|
Gelegentlich |
Abdominale Beschwerden†, Dyspepsie*, ösophageale Schmerzen*, Ösophagusspasmus, orale Beschwerden*, orale Schmerzen, geschwollene Zunge* | |
|
Erkrankungen der Haut und des Unterhautgewebes |
Häufig |
Urtikaria3, Ausschlag2, Pruritus, Hyperhidrosis |
|
Gelegentlich |
Hautverfärbung, Hautödem* | |
|
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen |
Häufig |
Muskelkrämpfe, Myalgie, Arthralgie, muskuläre Schwäche |
|
Gelegentlich |
Flankenschmerz, Muskelermüdung, muskuloskelettale Steifigkeit | |
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Häufig |
Ermüdung, Fieber, Schüttelfrost, Brustkorbbeschwerden*, Schwellung an der Infusionsstelle*, Schmerz*, periphere Schwellung |
|
Gelegentlich |
Asthenie, Gesichtsschmerzen, Gefühl der Zerfahrenheit†, Schmerzen an der Infusionsstelle*, Unwohlsein*, Thoraxschmerz nicht kardialen Ursprungs, Gesichtsschwellung*, Fluktuation der Körpertemperatur* | |
|
Erkrankungen des Blut- und Lymphsystems |
Gelegentlich |
Lymphozytenzahl erniedrigt, Thrombozytenzahl erniedrigt† |
|
Verletzung, Vergiftung und durch Eingriffe bedingte Komplikationen |
Gelegentlich |
Hautabschürfung* |
* Nur für Cipaglucosidase alfa berichtet
† Nur für Miglustat berichtet
1 Anaphylaxie, anaphylaktische Reaktion, und anaphylaktoide Reaktion sind unter anaphylaktische Reaktionenzusammengefasst.
2 Ausschlag, erythematöser Hautausschlag und makulärer Hautausschlag werden unter Ausschlag zusammengefasst.
3 Urtikaria, Nesselausschlag und mechanische Urtikaria werden unter Urtikaria zusammengefasst.
4 Migräne und Migräne mit Aura werden unter Migräne zusammengefasst.
5 Tachykardie und Sinustachykardie werden unter Tachykardie zusammengefasst.
6 Abdominalschmerz, Schmerzen im Oberbauch und Schmerzen im Unterbauch werden unter Abdominalschmerz zusammengefasst.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Anzeichen und Symptome
Leukopenie, Granulozytopenie, Neutropenie, Schwindelgefühl, Parästhesie wurden bei Patienten mit humanem Immundefizienz-Virus (HIV) beobachtet, die Miglustat in einer Dosierung von 800 mg/Tag oder höher erhielten.
Behandlung
Im Falle einer Überdosierung hat sofort eine unterstützende medizinische Versorgung erfolgen. Das grosse Blutbild ist auf eine Verminderung der Anzahl weisser Blutkörperchen zu überwachen.
Eigenschaften/Wirkungen
ATC-Code
A16AX06
Wirkungsmechanismus / Pharmakodynamik
Miglustat ist ein pharmakokinetischer Enzymstabilisator von Cipaglucosidase alfa.
Miglustat bindet während der Infusion selektiv an Cipaglucosidase alfa im Blut; dadurch wird die Konformation von Cipaglucosidase alfa stabilisiert und der Verlust der Enzymaktivität während der Zirkulation minimiert. Diese selektive Bindung zwischen Cipaglucosidase alfa und Miglustat ist vorübergehend, wobei die Disassoziation im Lysosom stattfindet. Miglustat allein hat keine Wirkung auf den Glykogenabbau.
Klinische Wirksamkeit
Siehe die Fachinformation für Pombiliti (siehe Abschnitt "Klinische Wirksamkeit").
Pharmakokinetik
Absorption
Die Absorptionsrate (tmax) von Miglustat betrug etwa 2 bis 3 Stunden. Bei der klinischen Dosis von 260 mg erreichte Miglustat im Plasma eine Cmax von etwa 3000 ng/ml und eine AUC0-∞ von etwa 25000 ng·h/ml.
Einfluss von Nahrung
Nahrung hatte einen signifikanten Effekt, sie verringerte die Cmax um 36% und verzögerte die Absorption um etwa 2 Stunden, siehe Abschnitt „Dosierung/Anwendung“.
Distribution
Nicht zutreffend.
Metabolismus
Miglustat wird kaum metabolisiert; <5% einer radioaktiv markierten Dosis wurden zu Glukuroniden abgebaut.
Elimination
Die terminale Halbwertszeit für Miglustat betrug etwa 6 Stunden. Die orale Clearance betrug etwa 10,5 l/h und das Verteilungsvolumen in der terminalen Phase lag bei etwa 90 l.
Linearität/nicht-Linearität
Miglustat zeigte eine dosisproportionale Kinetik.
Kinetik spezieller Patientengruppen
Leberfunktionsstörungen
Die Pharmakokinetik von Miglustat in Kombination mit Cipaglucosidase alfa wurde bei Patienten mit Leberfunktionsstörung nicht untersucht.
Nierenfunktionsstörungen
Die AUC0-24h von Miglustat stieg bei Patienten mit leichter (Kreatinin-Clearance (CrCl) 60 bis 89 ml/Minute, geschätzt nach Cockcroft-Gault), mittelschwerer (CrCl 30 bis 59 ml/Minute) bzw. schwerer (CrCl 15 bis 29 ml/Minute) Nierenfunktionsstörung im Vergleich zu Patienten mit normaler Nierenfunktion um 21%, 32% bzw. 41% an. Die Auswirkung von terminaler Niereninsuffizienz auf die Pharmakokinetik von Miglustat ist nicht bekannt.
Geschlecht, ältere Patienten und ethnische Zugehörigkeit
Basierend auf einer gepoolten populationspharmakokinetischen Analyse hatten Geschlecht, Alter (18 bis 74 Jahre) und ethnische Zugehörigkeit keinen klinisch bedeutsamen Einfluss auf die Exposition gegenüber Miglustat in Kombination mit Cipaglucosidase alfa.
Präklinische Daten
Basierend auf den konventionellen Studien zur Sicherheitspharmakologie, Toxizität bei einmaliger und wiederholter Gabe und Genotoxizität lassen die präklinischen Daten keine besonderen Gefahren für den Menschen erkennen.
Karzinogenität
Nach oraler Behandlung mit Miglustat in einer Dosierung von 210, 420 und 840/500 mg/kg/Tag über einen Zeitraum von 2 Jahren traten bei Mäusen gelegentlich Karzinome im Dickdarm auf. Diese Dosen entsprechen dem 8-, 16- und 33/19-fachen einer menschlichen Dosis von 200 mg dreimal täglich. Die Relevanz dieser Befunde für Menschen, die Miglustat einnehmen, ist für die erheblich niedrigeren untersuchten Dosen von 195 bis 260 mg alle zwei Wochen zur Behandlung von Morbus Pompe nicht bekannt.
Die orale Verabreichung von Miglustat an männliche und weibliche Sprague-Dawley-Ratten mit Dosierungen von 30, 60 und 180 mg/kg/Tag (ungefähr die 1-, 2-, und 5-fache maximal empfohlene humane Dosis [MRHD] von Opfolda 260 mg basierend auf der Körperoberfläche [BSA]) über 2 Jahre führte zu einem dosis-unabhängigen Anstieg der Inzidenz von Hyperplasien testikulärer interstitieller Zellen und interstitiellen testikulären Adenomen. In Untersuchungen wurde ein Ratten-spezifischer Mechanismus gezeigt, der als von niedriger Relevanz für den Menschen eingestuft wird.
Reproduktions- und Entwicklungstoxikologie
In einer Studie bei männlichen Ratten zeigte Miglustat in Kombination mit Cipaglucosidase alfa oder Miglustat allein keinen Einfluss auf die Spermatogenese.
In einer Studie mit einem anderen Miglustat-Produkt bei Ratten führte die orale Verabreichung von Miglustat zu einer Atrophie/Degeneration der Samenkanälchen und der Hoden, bei einer 2-fachen Exposition der maximal empfohlenen menschlichen Dosis (MRHD) basierend auf der Körperoberfläche (mg/m2). Ausserdem wurde eine verringerte Spermatogenese mit veränderter Spermienmorphologie und -motilität sowie eine verringerte Fertilität bei Ratten beobachtet, bei einer 0,6-fachen Exposition bezogen auf die Körperoberfläche. Die verringerte Spermatogenese war bei Ratten nach einem 6-wöchigen Wirkstoffentzug reversibel.
In einer Studie zur Fertilität und frühen Embryonalentwicklung bei Ratten ein erhöhter Präimplantationsverlust sowohl bei Miglustat allein als auch in der Kombinationsbehandlungsgruppe beobachtet und als Miglustat-bedingt angesehen. Bei der Kombinationsbehandlung betrugen die Plasma-AUC-Expositionen von Cipaglucosidase alfa und Miglustat das 27- bzw. 4-Fache der MRHD. Es gab für diesen Effekt keinen No-observed-adverse-effect-level (NOAEL) in der Kombinationsgruppe.
In einer embryo-fötalen Entwicklungsstudie wurden bei trächtigen Ratten oder deren Nachkommen keine nachteiligen Befunde beobachtet, die direkt auf Cipaglucosidase alfa oder Miglustat zurückzuführen waren.
In einer Studie mit einem anderen Miglustat-Produkt verringerte Miglustat das Überleben von Embryonen/Föten in Ratten und Kaninchen. Ein verlängerter Geburtsprozess, erhöhte Inzidenzen für Postimplantationsverluste und für Gefässanomalien wurden bei Kaninchen beobachtet. Diese Effekte stehen möglicherweise zum Teil im Zusammenhang mit Toxizität auf das Muttertier. Bei weiblichen Ratten wurden in einer einjährigen Studie Veränderungen bei der Laktation beobachtet.
In einer Studie zur embryo-fötalen Entwicklung an Kaninchen zeigten sich maternale Auswirkungen, darunter verringerte Nahrungsaufnahme und Gewichtszunahme, sowohl bei Miglustat allein als auch bei der Kombinationsgruppe. Die Kombination von Cipaglucosidase alfa mit Miglustat (aber nicht Cipaglucosidase alfa ohne Miglustat) führte bei Kaninchenföten bei 16-facher bzw. 3-facher Exposition der MRHD von Cipaglucosidase alfa bzw. Miglustat, basierend auf einer Einzeldosis, oder 112-facher bzw. 21-facher Exposition bei kumulativer Dosierung zu vermehrten kardiovaskulären Missbildungen (atretischer Pulmonalstamm, Ventrikelseptumdefekt und erweiterter Aortenbogen). Es kann jedoch nicht ausgeschlossen werden, dass die bei den Kaninchen beobachteten embryo-fötalen Nebenwirkungen nach einer einmaligen Exposition gegenüber der Kombination aufgetreten sein könnten. Eine NOAEL-Dosis konnte für die Kombinationsgruppe nicht festgelegt werden, da nur eine einzige Kombinationsdosis getestet wurde.
In einer prä- und postnatalen Studie an Ratten wurden keine schädlichen Auswirkungen auf das Muttertier oder auf die postnatale Entwicklung beobachtet, die direkt auf Cipaglucosidase alfa oder Miglustat zurückzuführen waren. Die Untersuchung der Milch von Ratten aus der Kombinationsbehandlungsgruppe zeigte eine Sekretion von Miglustat und Cipaglucosidase alfa in die Rattenmilch. 2,5 Stunden nach der Verabreichung betrug das Verhältnis der Cipaglucosidase alfa-Exposition in der Rattenmilch zu der im Plasma 0,038.
Sonstige Hinweise
Inkompatibilitäten
Da keine Verträglichkeitsstudien vorliegen, darf dieses Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Nicht über 30°C lagern.
Ausser Reichweite von Kindern aufbewahren.
Zulassungsnummer
67806 (Swissmedic)
Packungen
Flaschen mit 4 und 24 Kapseln [B].
Zulassungsinhaberin
Amicus Therapeutics Switzerland GmbH
Seefeldstrasse 69
CH-8008 Zürich
Schweiz
Stand der Information
Mai 2025